В любом образце радиоактивного вещества содержится огромное число радиоактивных атомов. Так как радиоактивный распад имеет случайный характер и не зависит от внешних условий, то закон убывания количества N(t) нераспавшихся к данному моменту времени t ядер может служить важной статистической характеристикой процесса радиоактивного распада.
Пусть за малый промежуток времени Δt количество нераспавшихся ядер N(t) изменилось на ΔN < 0. Так как вероятность распада каждого ядра неизменна во времени, что число распадов будет пропорционально количеству ядер N(t) и промежутку времени Δt:
| ΔN = –λN(t)Δt. |
Коэффициент пропорциональности λ – это вероятность распада ядра за время Δt = 1 с. Эта формула означает, что скорость  изменения функции N(t) прямо пропорциональна самой функции.
изменения функции N(t) прямо пропорциональна самой функции.
|
Подобная зависимость возникает во многих физических задачах (например, при разряде конденсатора через резистор). Решение этого уравнения приводит к экспоненциальному закону:
|
где N0 – начальное число радиоактивных ядер при t = 0. За время τ = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2,7 раза. Величину τ называют средним временем жизни радиоактивного ядра.
Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e:
|
Величина T называется периодом полураспада. За время T распадается половина первоначального количества радиоактивных ядер. Величины T и τ связаны соотношением

|
Рис. 4. иллюстрирует закон радиоактивного распада.
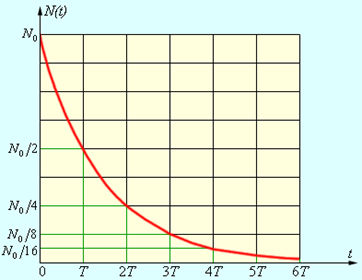
| Рисунок 4. Закон радиоактивного распада. |
Период полураспада – основная величина, характеризующая скорость радиоактивного распада. Чем меньше период полураспада, тем интенсивнее протекает распад. Так, для урана T ≈ 4,5 млрд. лет, а для радия T ≈ 1600 лет. Поэтому активность радия значительно выше, чем урана. Существуют радиоактивные элементы с периодом полураспада в доли секунды.
При α- и β-радиоактивном распаде дочернее ядро также может оказаться нестабильным. Поэтому возможны серии последовательных радиоактивных распадов, которые заканчиваются образованием стабильных ядер. В природе существует несколько таких серий. Наиболее длинной является серия 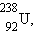 состоящая из 14 последовательных распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается стабильным изотопом свинца
состоящая из 14 последовательных распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается стабильным изотопом свинца  (рис. 5).
(рис. 5).

| Рисунок 5.
Схема распада радиоактивной серии 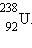 Указаны периоды полураспада. Указаны периоды полураспада.
|
В природе существуют еще несколько радиоактивных серий, аналогичных серии 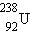 . Известна также серия, которая начинается с нептуния
. Известна также серия, которая начинается с нептуния  не обнаруженного в естественных условиях, и заканчивается на висмуте
не обнаруженного в естественных условиях, и заканчивается на висмуте  . Эта серия радиоактивных распадов возникает в ядерных реакторах.
. Эта серия радиоактивных распадов возникает в ядерных реакторах.
Правило смещения. Правило смещения точно указывает, какие именно превращения претерпевает химический элемент, испуская радиоактивное излучение.
Радиоактивные ряды
Правило смещения позволило проследить превращения естественных радиоактивных элементов и выстроить из них три генеалогических дерева, родоначальниками которых являются уран-238, уран-235 и торий-232. Каждое семейство начинается с чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство, например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5·109 лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
| Таблица 1. Радиоактивное семейство урана | |||||
| Радиоактивный элемент | Z | Химический элемент | А | Тип излуче- ния | Период полурас- пада |
| Уран I | Уран | | 4,519 лет | ||
| Уран X1 | Торий | | 24,1 сут | ||
| Уран X2 Уран Z | Протактиний Протактиний | – (99,88%) (,12%) | 1,14 мин ,7 ч | ||
| Уран II | Уран | | 2,515 лет | ||
| Ионий | Торий | | 814 лет | ||
| Радий | Радий | | 1620 лет | ||
| Радон | Радон | | 3,8 сут | ||
| Радий А | Полоний | | 3,05 мин | ||
| Радий В | Свинец | | 26,8 мин | ||
| РадийС Радий С | 83 83 | Висмут Висмут | 214 214 | (99,96%) (0,04%) | 19,7 мин 19,7 мин |
| Радий С | Полоний | | 1,61–4 с | ||
| Радий С | Таллий | | 1,3 мин | ||
| Радий D | Свинец | | 25 лет | ||
| Радий Е | Висмут | | 4,85 сут | ||
| Радий F | Полоний | | 138 сут | ||
| Радий G | Свинец | Стабилен |
Семейство урана. На элементах семейства урана можно проследить большинство обсуждавшихся выше свойств радиоактивных превращений. Так, например, у третьего члена семейства наблюдается ядерная изомерия. Уран X2, испуская бета-частицы, превращается в уран II (T = 1,14 мин). Это соответствует бета-распаду возбужденного состояния протактиния-234. Однако в 0,12% случаев возбужденный протактиний-234 (уран X2) излучает гамма-квант и переходит в основное состояние (уран Z). Бета-распад урана Z, также приводящий к образованию урана II, происходит за 6,7 ч.
Радий С интересен тем, что может распадаться двумя путями: испуская либо альфа-, либо бета-частицу. Эти процессы конкурируют между собой, но в 99,96% случаев происходит бета-распад с образованием радия С. В,4% случаев радий С испускает альфа-частицу и превращается в радий С (RaC). В свою очередь RaC и RaC путем эмиссии альфа- и бета-частиц соответственно превращаются в радий D.
Изотопы. Среди членов уранового семейства встречаются такие, атомы которых имеют одинаковый атомный номер (одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим свойствам, но различаются по характеру радиоактивности. Например, радий B, радий D и радий G, имеющие одинаковый со свинцом атомный номер 82, подобны свинцу по химическому поведению. Очевидно, что химические свойства не зависят от массового числа; они определяются строением электронных оболочек атома (следовательно, и Z). С другой стороны, массовое число имеет решающее значение для ядерной стабильности радиоактивных свойств атома. Атомы с одинаковым атомным номером и разными массовыми числами называются изотопами. Изотопы радиоактивных элементов были открыты Ф.Содди в 1913, но вскоре Ф.Астон с помощью масс-спектроскопии доказал, что изотопы имеются и у многих стабильных элементов.
