Составьте конспект лекции по теме «Общая характеристика элементов V группы главной подгруппы периодической системы Д.И. Менделеева»
2. Дайте ответы на контрольные вопросы в письменном виде:
1. Перечислить элементы V группы главной подгруппы.
2. Как определить высшую валентность этих элементов?
3. Почему высшая валентность азота равна трем?
4. Каковы высшая и низшая степени окисления азота?
5. В каких соединениях атом азота будет проявлять степень окисления (− 3)?
6. Какие оксиды способен образовывать азот?
Выполненные задания присылать в личном сообщении ВК в виде фото или скринов (не перевернутые).
Срок сдачи: до 06.10.2020г.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ V ГРУППЫГЛАВНОЙ ПОДГРУППЫ.
Из элементов V группы ПС для медицины представляют интерес главная п/группа, которая включает азот, фосфор, мышьяк, сурьму и висмут.
В наружном слое атома этих элементов имеется пять электронов, поэтому способность к присоединению электронов выражена у них слабее, чем у соответствующих элементов VI и VII групп. С другой стороны, элементы главной подгруппы V гр. отдают электроны легче, чем элементы VI и VII групп, поэтому их кислородные соединения более устойчивы. Следовательно, элементы подгруппы проявляют одновременно положительную и отрицательную степени окисления.
Высшая положительная степень окисления элементов этой подгруппы
равна + 5, а отрицательная − 3.
Вследствие относительно меньшей ЭО связь данных элементов в водородом менее полярна, чем связь с водородом элементов VI и VII групп. В результате этого водородные соединения рассматриваемых элементов не отщепляются в водном растворе ионы водорода и поэтому не обладают кислотными свойствами
Характеристика азота по положению в Периодической системе химических элементов.
Азот (N) располагается во 2 периоде, в V группе, главной подгруппе, имеет порядковый номер 7. Массовое число: A = 14 Число протонов: P = 7 Число электронов: ē = 7 Число нейтронов: N = A - Z = 14 - 7 = 7 7N 1s2 2s2 2p3 Валентные электроны 7N ↑↓ ↑ ↑ ↑ 2s 2p Азот – p-элемент, неметалл. Степени окисления минимальная: -3 максимальная: +5 Высший оксид: N2O5 – оксид азота (V). Проявляет кислотные свойства:
N2O5 + 2NaOH ⟶ 2NaNO3 + H2O
Высший гидроксид: HNO3 – азотная кислота. Проявляет кислотные свойства: HNO3 + NaOH ⟶ NaNO3 + H2O
Водородное соединение в низшей степени окисления: NH3.
Нахождение в природе, получение азота:
Азот в природе встречается главным образом в свободном состоянии. В воздухе объемная доля его составляет 78,09%, а массовая доля - 75,6%. Соединения азота в небольших количествах содержатся в почвах. Азот входит в состав белковых веществ и многих естественных органических соединений. Общее содержание азота в земной коре 0,01%.
В атмосфере азота содержится примерно 4 квадрильона (4·1015) тонн, а в океанах - около 20 триллионов (20·1012) тонн. Незначительная часть этого количества - около 100 миллиардов тонн - ежегодно связывается и включается в состав живых организмов. Из этих 100 миллиардов тонн связанного азота только 4 миллиарда тонн содержится в тканях растений и животных - все остальное накапливается в разлагающих микроорганизмах и в конце концов возвращается в атмосферу.
В технике азот получают из воздуха. Для получения азота воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (tкипN2 = -195,8°С, tкипO2 = -183°С)
В лабораторных условиях чистый азот можно получить разлагая нитрит аммония или смешивая при нагревании растворы хлорида аммония и нитрита натрия:
NH4NO2 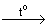 N2 + 2H2O; NH4Cl + NaNO2
N2 + 2H2O; NH4Cl + NaNO2 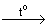 NaCl + N2 + 2H2O.
NaCl + N2 + 2H2O.
Физические свойства:
Природный азот состоит из двух изотопов: 14N и 15N. При обычных условиях азот - газ без цвета, запаха и вкуса, немного легче воздуха, плохо растворяется в воде (в 1 л воды растворяется 15,4 мл азота, кислорода - 31 мл). При температуре -195,8°C азот переходит в бесцветную жидкость, а при температуре -210,0°C - в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже -237,54°C устойчива форма с кубической решеткой, выше - с гексагональной.
Энергия связи атомов в молекуле азота очень велика и составляет 941,6 кДж/моль. Расстояние между центрами атомов в молекуле 0,110 нм. Молекула N2 диамагнитна. Это свидетельствует о том, что связь между атомами азота тройная.
Плотность газообразного азота при 0°C 1,25046 г/дм3
Химические свойства:
При обычных условиях азот - химически малоактивное вещество из-за прочной ковалентной связи. В обычных условиях реагирует только с литием, образуя нитрид:
6Li + N2 = 2Li3N
С повышением температуры активность молекулярного азота увеличивается, при этом он может быть может быть и окислителем (с водородом, металлами), и восстановителем (с кислородом, фтором). При нагревании, повышенном давлении и в присутствии катализатора азот взаимодействует с водородом образуя аммиак:
N2 + 3H2 = 2NH3
С кислородом азот соединяется только в электрической дуге с образованием оксида азотa(II):
N2 + O2 = 2NO
В электрическом разряде возможна и реакция со фтором:
N2 + 3F2 = 2NF3