Билет № 1
1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана.
3. Задача. Какая масса оксида алюминия образуется, если с кислородом прореагировало 2 моль алюминия?
.
Билет № 2
1. Строение атомов и закономерности в изменении свойств химических элементов на примере: а) элементов одного периода; б) элементов одной А-подгруппы.
2. Непредельные углеводороды ряда этилена, общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена.
3. Задача. Вычислите, во сколько раз пропан легче или тяжелее воздуха. Какова масса (в грамме) 1 л пропана при нормальных условиях?
Билет № 3
1. Виды химической связи: ионная, металлическая, ковалентная (полярная, неполярная); простые и кратные связи в органических соединениях.
2. Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
3. Задача. Сколько грамм хлорида цинка можно получить, имея 0,5 моль соляной кислоты?
Билет № 4
1. Классификация химических реакций в неорганической и органической химии.
2. Диеновые углеводороды, их химическое строение, получение и практическое значение.
Задача. Вычислите какой объем и какая масса хлора потребуются, чтобы получить 202 г хлорметана(при нормальных условиях)
Билет № 5
1. Химическое равновесие и условия его смещения: изменение концентрации реагирующих веществ, температуры, давления.
2. Ацетилен – представитель углеводородов с тройной связью в молекуле. Свойства, получение и применение ацетилена.
3. Задача. К акой объем водорода выделится при взаимодействии алюминия с раствором серной кислоты, содержащим 9,8 граммов H₂SO₄.
Билет № 6
1. Скорость химических реакций. Зависимость скорости от природы, концентрации реагирующих веществ, температуры, катализатора.
2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов.
3. Опыт. Проведение реакций, подтверждающих характерные химические свойства хлороводородной кислоты.
Билет № 7
1. Основные положения теории химического строения органических веществ А.М. Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах.
2. Реакции ионного обмена. Условия их необратимости.
3. Какой объём займут при нормальных условиях 17 грамм сероводорода(H2S)?
Билет № 8
1. Изомерия органических соединений и ее виды.
2. Важнейшие классы неорганических соединений.
3. Какая масса гидроксида алюминия может раствориться в 300 грамм 19,6%-ного раствора серной кислоты?
Билет № 9
1. Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
2. Природные источники углеводородов: газ, нефть, каменный уголь и их практическое использование.
3. Определите количество вещества и массу вод, образующуюся при взаимодействии 6 грамм водорода с кислородом.
Билет № 10
1. Неметаллы, положение в периодической системе химических элементов Д.И. Менделеева, строение их атомов. Окислительно-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.
2. Предельные одноатомные спирты, их строение, свойства. Получение и применение этилового спирта.
3.Задача. Какое кол-во оксида кальция может прореагировать с соляной кислотой массой 7,2 грамма?
Билет № 11
1. Аллотропия неорганических веществ на примере углерода и кислорода.
2. Фенол, его химическое строение, свойства, получение и применение.
3. Задача. К 80 граммам 15%-ного раствора сульфата натрия прибавили 20 грамм воды. Какова массовая доля этой соли в полученном растворе?
Билет № 12
1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
2. Альдегиды, их химическое строение и свойства. Получение, применение муравьиного и уксусного альдегидов.
3. Задача. При сгорании органического вещества массой 2, 37 грамм образовалось 3,36 грамм оксида углерода(IV) (при нормальных условиях), 1,35 грамм воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Билет № 13
1. Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д.И. Менделеева.
2. Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
3. Опыт. Проведение реакции, подтверждающие качественный состав серной кислоты. Напишите уравнение реакций
Билет № 14
1. Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе.
2. Жиры, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах.
3. Задача. Определите массу иодида натрия NaI количеством вещества 0,6 моль.
Билет № 15
1. Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
2. Целлюлоза, состав молекул, физические и химические свойства, применение. Понятие об искусственных волокнах на примере ацетатного волокна.
3. Задача. Определите количество вещества атомного бора, содержащегося в тетраборате натрия Na2B4O7 массой 40,4 грамм.
Ответы на задачи
Билет 1
Какая масса оксида алюминия образуется, если с кислородом прореагировало 2 моль алюминия?
Запишем условие задачи.
Дано: n(Al) = 2 моль
А также, что необходимо найти в ходе решения.
Найти: m (Al2O3) -?
Решение: 1). Запишем уравнение реакции, опираясь на условие задачи.
4 Al+ 3O2  2 Al2O3
2 Al2O3
2). Количество вещества оксида алюминия и количество вещества алюминия связывает соотношение:
 =
=  , где 2 и 4 – стехиометрические коэффициенты, стоящие в уравнении реакции соответственно перед оксидом алюминия и перед алюминием, отсюда n (Al2O3) = 1 n (Al)/2
, где 2 и 4 – стехиометрические коэффициенты, стоящие в уравнении реакции соответственно перед оксидом алюминия и перед алюминием, отсюда n (Al2O3) = 1 n (Al)/2
3). Найдем количество вещества оксида алюминия.
n (Al2O3) = 1 х 2/2 = 1 моль
4). Найдем массу оксида алюминия.
m (Al2O3) = M (Al2O3)* n (Al2O3)
m (Al2O3) = (2 х 27 + 3х 16) х 1 моль= 102 г
Запишем ответ.
Oтвет: m m (Al2O3) = 102 г.
Билет 2
Вычислите, во сколько раз пропан легче или тяжелее воздуха. Какова масса (в г) 1 л пропана при нормальных условиях?
Молекулярная формула пропана С3Н8. Вычислим молярную массу пропана:

Средняя молярная масса воздуха равна 29. Вычислим плотность пропана по воздуху:

Чтобы найти массу 1 л пропана, вычислим количество вещества пропана в 1 л:
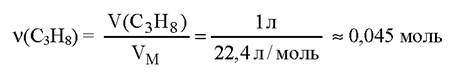
Найдем массу 1 л пропана:

Ответ: пропан в 1,52 раза тяжелее воздуха; масса 1 л пропана при н. у. равна 1,98 г.
Билет 3
Сколько г хлорида цинка можно получить, имея 0,5 моль соляной кислоты?
Решение:
1. Записываем уравнение реакции.
2. Записываем над уравнением реакции имеющиеся данные, а под уравнением – число моль согласно уравнению (равно коэффициенту перед веществом):
0,5 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
3. Составляем пропорцию:
0,5 моль – х моль
2 моль – 1 моль
4. Находим x:
x = 0,5 моль • 1 моль / 2 моль = 0,25 моль
5. Находим молярную массу хлорида цинка:
M(ZnCl2) = 65 + 35,5 • 2 = 136 (г/моль)
6. Находим массу соли:
m (ZnCl2) = M • n = 136 г/моль • 0,25 моль = 34 г
Ответ: 34 г.
Билет 4