В отличие от бактерий одним из первых ответов клеток животных на тяжелые повреждения ДНК является массированная полимеризация остатков ADP-рибозы специальным ферментом – полимеразой поли(ADP-рибозы) (poly(ADP-ribose polymerase) – PARP). В ядрах клеток млекопитающих PARP присутствует в количестве ~106 копий, и она обнаружена у большинства эукариот за исключением дрожжей. Процесс синтеза поли(ADP-рибозы) предшествует началу репарации повреждений ДНК. Большие затраты энергии на биосинтез этого полимера указывают на его важную, хотя и до конца не понятную, роль в выходе ядер клеток из стрессового состояния, вызванного премутационными повреждениями ДНК.
In vivoполи(ADP-рибоза) характеризуется очень малым временем полужизни. Цепи полимера, синтезированные в ядрах в ответ на мутагенное воздействие, в основном распадаются уже через 1–2 мин после завершения их синтеза. Такой быстрый обмен полимера в ядрах становится возможным благодаря совместному действию двух ферментов – PARP и гликозилазы поли(ADP-рибозы). Экспрессия PARP-кДНК в ядрах дрожжей, у которых отсутствуют оба фермента, летальна для клеток. Это связано, главным образом, с тем, что внутриядерное накопление поли(ADP-рибозы) сопровождается подавлением репликации ДНК и транскрипции.
Ген PARP, картированный на участке 1q41–1q42 хромосомы человека, кодирует полипептид, состоящий из двух функционально различающихся частей: N-концевого ДНК-связывающего и C-концевого каталитического доменов. Первый домен содержит две структуры типа "цинковые пальцы", которые обеспечивают взаимодействие PARP с разрывами в ДНК. С помощью футпринтинга установлено, что PARP связывается преимущественно с одноцепочечными разрывами ДНК, закрывая своей полипептидной цепью по семь–восемь нуклеотидов по обе стороны от разрыва. При этом PARP индуцирует образование V-образного изгиба ДНК в месте одноцепочечного разрыва. Для синтеза поли(ADP-рибозы) фермент использует NAD в качестве субстрата. Структурные аналоги NAD часто являются ингибиторами PARP, например 3-аминобензамид – один из самых эффективных ингибиторов PARP. Каталитический домен PARP обнаруживает гомологию с различными NAD-связывающими ферментами. Одноцепочечные разрывы, остающиеся между фрагментами Оказаки при синтезе отстающей цепи ДНК, не индуцируют образование поли(ADP-рибозы), вероятно, из-за их экранирования белками реплисомы.
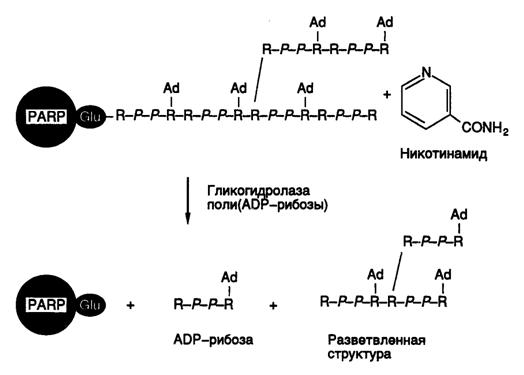
Рис. I.61. Схематическое изображение молекулы поли(ADP-рибозы), присоединенной к полипептидной цепи полимеразы поли(ADP-рибозы) и продуктов ее деградации
Синтез поли(ADP-рибозы) можно рассматривать как один из редких случаев посттрансляционной модификации белков, при которой PARP использует свою собственную полипептидную цепь в качестве субстрата (рис. I.61). Такая массированная аутомодификация резко изменяет физические свойства фермента. Остатки Glu (25–30), расположенные в полипептидной цепи PARP между двумя вышеупомянутыми доменами, служат точками инициации синтеза поли(ADP-рибозы). В процессе синтеза происходит разветвление полимера, и длина боковых цепей может достигать нескольких сотен остатков. В настоящее время до конца неизвестно, модифицирует ли молекула PARP сама себя или же это осуществляют другие молекулы PARP. На основании имеющихся кинетических данных наиболее вероятной считается модель, в соответствии с которой молекула PARP, ассоциированная с одноцепочечным разрывом, образует комплекс с другой молекулой и уже вторая молекула PARP служит акцептором полимеризуемой ADP-рибозы.
Гликогидролаза поли(ADP-рибозы) расщепляет цепи полимера с их концов, освобождая мономеры и олигомеры ADP-рибозы. Таким образом, в результате синтеза и деградации поли(ADP-рибозы) в ядрах образуются не только остатки никотинамида и ADP-рибозы, но и более сложные разветвленные продукты, состоящие из трех–четырех молекул мономера.
В присутствии ингибиторов PARP клетки животных становятся чрезвычайно чувствительными к действию алкилирующих агентов и ионизирующей радиации. Кроме того, в этом случае наблюдается повышенный уровень сестринских хроматидных обменов (СХО). Однако до сих пор нет доказательств прямого участия поли(ADP-рибозы) в репарации ДНК. Сверхэкспрессия рекомбинантного N-концевого домена PARP в клетках животных сопровождается теми же эффектами, что и действие ингибиторов PARP, в частности 3-аминобензамида. В неповрежденных клетках происходят дестабилизация генома и рост числа СХО. Опыты с трансгенными мышами, у которых ген PARP инактивирован в результате генного нокаута (см. раздел 10.3.4), показывают, что PARP-дефицитные мыши, тем не менее, здоровы и фертильны. Следовательно, PARP не играет существенной роли в пролиферации клеток, их дифференцировке и онтогенезе мыши. Клетки таких животных обладают нормальной способностью к эксцизионной репарации ДНК системами BER и NER. PARP-дефицитным мышам свойственны не совсем понятные физиологические дефекты, проявляющиеся в гиперплазии эпидермиса, вызванной повышенной пролиферацией кератиноцитов у старых особей, а также пониженной способностью тимоцитов к пролиферации после g-облучения. Клетки панкреатических островков у PARP-дефицитных мышей обладают повышенной устойчивостью к цитотоксическому действию NO. Это может указывать на недостаток NAD, вызываемый повышенным синтезом поли(ADP-рибозы), как одну из причин цитотоксичности NO у нормальных животных.
В настоящее время предложено несколько моделей, объясняющих физиологическую роль PARP в клетках животных. Все они подчеркивают, что PARP не участвует прямо в эксцизионной репарации ДНК, но необходима для быстрой мобилизации ресурсов клеток при исправлении повреждений их генома. Способность ингибиторов PARP вызывать гиперчувствительность клеток к алкилирующим агентам и ионизирующей радиации позволяет рассматривать этот фермент в качестве удобной мишени в химиотерапии опухолей.
Рассмотренные в данной главе механизмы образования мутаций указывают на большое разнообразие путей повреждения генетической информации, заключенной в экспрессирующихся и временно молчащих генах. Эволюционное развитие животного и растительного мира противопоставило мутагенным воздействиям мощное противоядие в виде эффективных систем репарации ДНК. Тем не менее, из-за ошибок систем репарации и повреждения самих этих систем происходит необратимое накопление мутаций, приводящих к нарушениям метаболизма и развитию различных патологических состояний организма. В этой связи еще более эффективным средством защиты генетической информации является блокирование (инактивация) химических мутагенов на подступах к жизненно важным генетическим локусам. Именно такую нагрузку несут рассмотренные выше ферментные системы детоксикации ксенобиотиков. На мой взгляд, одной из функций поли(ADP)-рибозы в клетках, подвергнутых мутагенному воздействию, может быть очистка ядер от мутагенов, ковалентно взаимодействующих с нуклеиновыми кислотами, в том числе свободных радикалов, возникающих под действием ионизирующего излучения. Это соединение может играть роль чистильщика (scavenger) ядер от химических мутагенов и понижать их внутриядерную концентрацию через образование соответствующих аддуктов. Синтез поли(ADP)-рибозы является быстрым адаптивным ответом клеток в ответ на массированное мутагенное воздействие. Однако в естественных условиях существования организмов такие ситуации встречаются редко. В природных условиях, свободных от присутствия антропогенных экологических факторов, скорее имеется слабый мутагенный фон, постоянно окружающий информационные макромолекулы на протяжении всей жизни организма. В недавно разработанной модели альтруистичной ДНК (Л.И. Патрушев, 1997 г.) избыточные последовательности нуклеотидов эукариотической ДНК рассматриваются в качестве еще одной специфической системы защиты генетической информации, характерной для многоклеточных организмов. Далее будут представлены основные положения этой модели.
Альтруистичная ДНК
Как следует из вышеизложенного, стабильность генетической информации любого организма обеспечивается двумя различными путями. Прежде всего, системы детоксикации ксенобиотиков и эндогенных мутагенов осуществляют блокирование токсического потенциала таких соединений путем их химических модификаций, обеспечивающих эффективное выведение из клетки и организма. С другой стороны, если генотоксические агенты, прорвав этот барьер, все-таки модифицируют ДНК, начинает функционировать многокомпонентная система репарации поврежденных генов.
Анализ структуры генома эукариот показывает, что для соматических клеток многоклеточного организма остается еще один путь защиты своего генома от мутагенов экзогенного и эндогенного происхождения – разбавление кодирующих последовательностей нуклеотидов некодирующими таким образом, чтобы последние выступали в роли ловушек мутагенов, будь то химические мутагены, непосредственно взаимодействующие с ДНК, или же модифицированные нуклеотиды с измененной специфичностью спаривания, ошибочно включаемые ДНК-полимеразами в ДНК из внутриклеточного пула модифицированных предшественников в процессе репликации. В живом организме, обеспечивающем поддержание внутриклеточного гомеостаза, внутриядерная среда соматических и половых клеток, включающая низкомолекулярные метаболиты, на протяжении больших промежутков времени (соизмеримых со временами клеточного цикла или даже продолжительности жизни самого организма) должна находиться в стационарном состоянии. Можно полагать, что в обычных экологических условиях, к которым организм адаптирован, внутриядерные мутагены, поступающие из цитоплазмы или образующиеся в самом ядре, находятся в стехиометрическом недостатке по отношению к потенциальным мишеням, способным их акцептировать, в том числе и азотистым основаниям геномной ДНК. Кроме того, в первом приближении можно считать, что расположенные по соседству кодирующие и некодирующие последовательности нуклеотидов ДНК в равной степени доступны действию на них внутриядерных мутагенов. В таких условиях вероятность образования аддуктов внутриядерных мутагенов с кодирующими последовательностями нуклеотидов геномной ДНК будет прямо пропорциональна их суммарной длине (доле) в геномной ДНК или обратно пропорциональна "разбавлению" этих последовательностей некодирующими последовательностями нуклеотидов. Такое разбавление могло бы произойти в результате эволюционных преобразований генома-предшественника путем включения в него некодирующих избыточных последовательностей при участии разных молекулярных механизмов.
Вовлечение систем репарации повреждений ДНК в поддержание генетической стабильности информационных макромолекул клетки является вынужденной мерой, указывающей на то, что действие всех остальных систем защиты не обеспечивает полной сохранности нативного состояния генома. Тем не менее, любая генетическая система будет функционировать надежнее в том случае, если наиболее важные в обеспечении жизнедеятельности генетические локусы будут дополнительно защищены от действия химических мутагенов. Действительно, с точки зрения защиты информации гораздо большего эффекта можно достичь путем создания дополнительных препятствий на пути генотоксических агентов к таким локусам, чем репарацией поврежденных генов, так как в последнем случае не всегда повреждение может быть исправлено и исходная первичная структура ДНК восстановлена. Как следует из дальнейшего изложения, любому, и особенно эукариотическому, геному свойственна дифференциальная защита индивидуальных генетических локусов с помощью очень простого механизма. Необходимость дополнительной защиты генетической информации особенно актуальна для многоклеточных организмов в связи с тем, что у них существует опасность накопления соматических мутаций во время онтогенетического развития, когда создаются гигантские клоны высококооперированных и специализированных соматических клеток.