Как уже отмечалось ранее, адсорбцией называется сгущение газообразного или растворенного вещества на поверхности раздела фаз. Газ или растворенное вещество принято называть в этом случае адсорбтивом, а жид-кость или твердое тело, адсорбировавшее их, — адсорбентом. Для твердых адсорбентов характерно явление абсорбции - поглощение вещества в объеме. Адсорбция и абсорбция объединяются общим термином - сорбция.
Так как адсорбция является поверхностным явлением, она имеет огромное значение для коллоидных систем, обладающих большой поверхностью. Коагуляция лиозолей, пептизация коллоидных осадков, изменение знака заряда частиц и тому подобные явления теснейшим образом связаны с адсорбцией.
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. Известно, что если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие:
Сорбция ↔ Десорбция.
Десорбция обусловлена тепловым движением. При адсорбции на поверхности возникает адсорбционный комплекс, который при десорбции разрушается, и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных — неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8 — 40 кДж/моль, т.е. соизмерима с теплотой конденсации.
4. С повышением температуры адсорбция уменьшается, так как увеличивается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента.
Особенности химической адсорбции:
1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими-то внешними воздействиями.
2. Специфичность. Адсорбция происходит, если возможна химическая реакция.
3. Высокая теплота адсорбции, которая может достигать 800-1000кДж/моль, т.е. сопоставима с тепловыми эффектами химических реакций.
4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия.
Количественно адсорбция может быть выражена:
1) величиной а, представляющей собою количество адсорбтива, находящегося в объеме адсорбционного слоя, отвечающего единице массы адсорбента. Эту величину обычно измеряют в моль/г;
2) величиной α, показывающей количество адсорбированного вещества, приходящегося на единицу поверхности адсорбента. Эта величина представляет собой поверхностную концентрацию адсорбтива. Единицами измерения ее являются моль/м2и ммоль/см2.
3) введенной Гиббсом величиной Г, представляющей собою избыток числа моль адсорбтива в объеме поверхностного слоя площадью 1 см2 по сравнению с числом его моль в том же объеме, если бы у межфазной границы не происходило изменения концентрации адсорбтива. При малых концентрациях адсорбтива гиббсовская адсорбция Г близка к поверхностной концентрации α, при больших концентрациях адсорбтива величина Г отличается от α. В случаях, когда по тем или иным причинам концентрация в поверхностном слое меньше его концентрации в объеме, величина Г отрицательна, а само явление называется отрицательной адсорбцией.
Адсорбцию можно характеризовать:
1) зависиостью количества адсорбированного вещества а от температуры при постоянных равновесных давлении р или концентрации с; графики а = f(T] при р = const называются изобарами, а при с = const — изопикнами адсорбции (рис.20 б);

|
| Рис. 20. Изотерма (а), изобара (б), изостера (в) адсорбции |
2) зависимостью равновесного давления (или концентрации) от температуры при постоянном количестве адсорбированного вещества; графики р = f(T) и с = f(T) при а = const называются изостерами (рис. 20 в)
3) зависимостью количества адсорбированного вещества а от равновесного давления (или концентрации) при постоянной температуре; графики а = f (р) или а = f(c) при Т = const называются изотермами адсорбции (рис. 20а). Изотермы имеют особенно большое значение при изучении адсорбции, поэтому в дальнейшем мы ограничимся в основном рассмотрением этой зависимости.
4.1 ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ АДСОРБЦИИ ЛЕНГМЮРА
Адсорбция газа на твердом теле является простейшим случаем адсорбции, так как система газ - твердое тело состоит всего из двух компонентов. Поэтому адсорбция газа твердым телом особенно удобна для теоретического рассмотрения явления адсорбции.
Имеется несколько теорий физической адсорбции, из которых рассмотрим прежде всего теорию мономолекулярной адсорбции, предложенную в 1915 г. американским ученым Ленгмюром.
При ее разработке Ленгмюр исходил из следующих положений.
1. Адсорбция является локализованной и вызывается силами, близкими к химическим. Однако следует отметить, что Ленгмюр считал химическими все силы, обусловливающие когезионную прочность вещества, а также проявляющиеся в явлениях испарения, кристаллизации, поверхностного натяжения и т.д.
2. Адсорбция молекул адсорбтива происходит на активных центрах, всегда существующих на поверхности адсорбента. Такими центрами могут быть пики и возвышения, имеющиеся на любой, даже самой гладкой поверхности. В результате большой ненасыщенности силового поля около таких пиков и выступов эти участки обладают способностью удерживать налетающие молекулы газа, причем центр тем более активен, чем ненасыщеннее молекулы адсорбента на его поверхности. Ряд исследователей считает также, что активными центрами являются ребра и углы кристаллов и границы зерен в микронеоднородном или, как говорят, микрогетерогенном адсорбенте, около которых образуются особенно интенсивные силовые поля.
Обычно принимают, что активные центры занимают лишь незначительную часть поверхности адсорбента. Эту точку зрения подтверждает то обстоятельство, что количество яда, отравляющего катализатор, как правило, гораздо меньше того количества, которое потребовалось бы для покрытия ядом всей адсорбционной поверхности.
3. Вследствие малого радиуса действия адсорбционных сил, имеющих природу, близкую к химической, и способности их к насыщению каждым активный центр, адсорбируя молекулу адсорбтива, становится уже неспособным к дальнейшей адсорбции. В результате этого на поверхности адсорбента может образоваться только мономолекулярный слой адсорбтива.
4. Адсорбированные молекулы удерживаются активными центрами только в течение определенного промежутка времени. Через некоторое время, в результате флуктуации кинетической энергии, молекулы отрываются от поверхности адсорбента и переходят в газовую фазу. Взамен этих молекул активные центры могут адсорбировать новые молекулы, которые в свою очередь десорбируются, и т. д.
5. Ленгмюр не учитывал силы взаимодействия между адсорбированными молекулами.
Исходя из приведенных выше положений, Ленгмюр смог дать общее уравнение изотермы локализованной адсорбции, пригодное как для описания адсорбции газов, так и растворенных веществ.
Для вывода этого уравнения применительно к адсорбции газа представим локализованную адсорбцию как квазихимическую реакцию между молекулой газа и активным центром адсорбента, в результате которой образуется адсорбционный комплекс:
молекула газа + активный центр адсорбента ↔ адсорбционный комплекс
Обозначая через Г∞ предельное количество адсорбата в монослое, как было принято ранее, можно представить Θ как отношение Г/Г∞, следовательно:
 . (38)
. (38)
Получаем уравнение Ленгмюра, идентичное выведенному ранее.
Проанализируем изотерму Ленгмюра (см. рис. 21). В области малых давлений (участок I) Kp<<1 и Г = Г∞Kp - область Генри (Г ~ р). При больших давлениях (участок III) Kp>>1 и Г = Г∞. При средних давлениях (участок II) Г = Kp1/n, т.е. уравнение Фрейндлиха.
Константы уравнения Ленгмюра (Г∞ и K) определяют по экспериментальной изотерме адсорбции (см. рис.21). Предельную адсорбцию Г∞ находят как значение ординаты, отсекаемой асимптотой изотермы. Для определения константы К проводят касательную к изотерме из начала координат, на асимптоте отсекается отрезок А = 1/K. Константа К характеризует наклон прямолинейного участка изотермы при малых давлениях - это мера адсорбционной активности вещества.
4.2 ТЕОРИЯ ПОЛИМОЛЕКУЛЯРНОЙ АДСОРБЦИИ БЭТ
С.Брунауэр, П.Эммет и Э.Теллер разработали теорию применительно к адсорбции паров (теория БЭТ).
Отличительной чертой адсорбции паров является переход к объемной конденсации при предельном давлении, равном давлению насыщенного пара жидкости (р = рs). При этих условиях величина адсорбции паров, смачивающих твердое тело, становится бесконечной. Поэтому, если в области заполнения монослоя рост адсорбции замедляется с повышением давления, т.е. на изотерме имеется выпуклый участок, то при дальнейшем повышении давления (при приближении р к рs), рост адсорбции увеличивается.
Для полимолекулярной адсорбции пара выведено уравнение БЭТ:
 , (39)
, (39)
где am - емкость одного плотного слоя
с = К1/KL, К1 - константа равновесия образования единичных комплексов (К1 > К2 ≈ К3 ≈ ≈ KL).
К1
пар + свободная поверхность ↔ единичный комплекс
К2
пар + единичный комплекс ↔ двойной комплекс
К3
пар + двойной комплекс ↔ тройной комплекс и т.д.
При малых значениях p/ps и с>>1 уравнение БЭТ переходит в уравнение Ленгмюра:
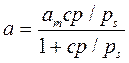 .
.
Теория БЭТ представляет попытку дать универсальную теорию физической адсорбции, которая охватывала бы все типы экспериментальных изотерм (рис.25).
Теория БЭТ применима главным образом в случае адсорбции газов и паров на твердых поверхностях и предусматривает образование на поверхности адсорбента одного, двух и последующих слоев молекул адсорбата. При этом, по аналогии с теорией Ленгмюра, оценивается абсолютная адсорбция.
4.3 АДСОРБЦИЯ НА ПОРИСТЫХ МАТЕРИАЛАХ
Характерной особенностью твердых поверхностей является их пористость. Природа поверхности адсорбента, размеры и форма его пор влияют на адсорбцию, изменяют ее количественные и качественные характеристики, т.е. механизм адсорбции.
Несмотря на разнообразие адсорбционных процессов, они всегда связаны с особой структурой твердой поверхности, и, в частности, с пористостью адсорбента.
Твердые поверхности в качестве адсорбентов используются для адсорбции газов или жидкостей, адсорбционные процессы при этом протекают на границе раздела твердое тело - газ (Т-Г) и твердое тело - жидкость (Т-Ж).
В отличие от поверхности жидкости поверхность твердых тел геометрически и энергетически неоднородна, твердые адсорбенты могут иметь поры. Одной из основных характеристик подобных адсорбентов является пористость П, она равна отношению суммарного объема пор Vп к общему объему адсорбента Vоб, т.е. П = Vп / Vоб. В зависимости от пористости твердые адсорбенты делятся на две группы: непористые и пористые.
Непористые адсорбенты, получаемые в результате осаждения кристаллических осадков, например сульфата бария, или размолом кристаллических и стеклообразных тел, обладают сравнительно небольшой удельной поверхностью (S≈10 м2∕г). Наполнители резин – черные сажи; кремнийорганические соединения, белые сажи, аэросилы - наполнители полимеров, смазок, лаков и т.п. имеют Sуд порядка нескольких сотен м2∕г. Адсорбенты, используемые в качестве осушителей, поглотителей в противогазах, активных катализаторов или носителей каталитически активных веществ, а также при адсорбционном разделении смесей имеют Sуд от сотен до нескольких тысяч м2∕г.
Пористые адсорбенты со столь высокой удельной поверхностью могут быть получены различными способами.
Первый способ заключается в построении твердого скелета адсорбента из малых частиц коллоидных размеров. Эти частицы (корпускулы), слипаясь или срастаясь у мест контакта, образуют скелет с огромной внутренней поверхностью. Примерами адсорбентов с корпускулярной структурой являются многие высушенные гели: силикагели, алюмогели, феррогели и т.д. Поры в адсорбентах корпускулярной структуры представляют зазоры между корпускулами. Размеры пор определяются размерами корпускул и их упаковкой. Если размеры частиц не сильно отличаются и упаковка близка к правильной, то образуются адсорбенты с однопористой структурой.
Второй способ заключается в воздействии на грубодисперсные или непористые тела (кокс, стекло) агрессивных газов или жидкостей. Например, при воздействии на неактивный уголь газов-окислителей (Н2О или СО2) при 850-950 °С часть вещества выгорает и получается так называемый активный уголь, пронизанный тонкими порами. Скелеты таких адсорбентов обладают в основном губчатой структурой.
Поверхность раздела фаз у непористых адсорбентов соответствует контуру твердого тела. У пористых адсорбентов эта поверхность значительно больше за счет наличия пор. Часто пористые адсорбенты применяют в виде порошков. Адсорбция на порошкообразных адсорбентах определяется их удельной поверхностью, которая значительно превышает удельную поверхность непористых адсорбентов и в большей степени зависит от поверхности пор, чем от поверхности, определяющей контур частиц.
Характеристика непористых и пористых порошкообразных адсорбентов приведена в табл. 3. Пористые адсорбенты могут иметь поры различного размера, в зависимости от чего они делятся на микропористые, мезопористые или переходнопористые, а также на макропористые. Диаметр микропор соизмерим с размерами молекул.
Пористость не только резко повышает удельную поверхность адсорбента, но и влияет на механизм адсорбции.
Адсорбция на микропористых адсорбентах заключается в объемном заполнении пространства пор, а адсорбция на мезопористых адсорбентах - в капиллярной конденсации паров адсорбата. Адсорбционная емкость микропор определяется не только их удельной поверхностью, но и объемом самих микропор. В промышленности применяют микро- и мезопористые адсорбенты на основе минеральных веществ и угольных материалов.
Таблица 3
Характеристика адсорбентов
| Адсорбенты | Диаметр пор*, нм | Удельная поверхность, м2/кг |
| Непористые | - | 1 - 500 |
| Макропористые | > 4,0 | (0,5 - 2,0)103 |
| Мезопористые | 1,2 - 4,0 | < 4 105 |
| Микропористые | <1,2 | > 4 105** |
*Размер пор приведен по классификации М. М. Дубинина,
**Объем микропор обычно составляет не более 0,5·10-3 м3/кг (0,5 см3/г).
К непористым адсорбентам относятся, например, некоторые полимеры и металлы. У пористых адсорбентов резко увеличивается площадь раздела фаз не только в результате дисперсности, но и дополнительно за счет площади самих пор.
4.4 КАПИЛЛЯРНАЯ КОНДЕНСАЦИЯ
Удерживание газов и паров пористыми телами, их адсорбционная способность зависят как от природы взаимодействующих тел, так и от структуры пористого тела. Если структурный фактор для макропористых адсорбентов имеет малое значение, то для переходно-пористых тел его роль резко возрастает. Это обусловлено в первую очередь проявлением капиллярных сил. Очевидно, что появление нового качества пористого тела с ростом его дисперсности непосредственно связано со сродством адсорбата к адсорбенту. Основываясь на закономерностях капиллярных явлений, можно утверждать, что такое сродство должно быть достаточным, чтобы поверхность пористого тела смачивалась жидкостью, появляющейся в результате конденсации пара в порах. Только при соблюдении условия смачивания капиллярные силы будут втягивать адсорбат в поры и увеличивать адсорбционную способность пористого тела. Чем меньше размер пор, тем сильнее капиллярное удерживание адсорбата. В противном случае (если поверхность не смачивается) наблюдается капиллярное выталкивание вещества из пор, адсорбция на таких телах минимальна и возможна только на ровной поверхности и в крупных порах.
Адсорбция на переходно-пористых телах происходит в основном по механизму капиллярной конденсации. Она начинает проявляться при определенной степени заполнения адсорбента или при определенном значении давления пара, характерном для данной системы. К этому моменту поверхностная энергия адсорбента практически полностью скомпенсирована в результате полимолекулярной адсорбции, а микропоры заполнены адсорбатом. С увеличением давления газа или пара заполняются конденсатом все более крупные поры, размеры радиусов менисков в которых находятся в соответствии с уравнением капиллярной конденсации Томсона-Кельвина (раздел 2.4) в случае отрицательной кривизны:
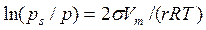 .
.
Из этого уравнения видно, что при смачивании, обеспечивающем отрицательную кривизну мениска конденсата (вогнутый мениск), конденсация в порах наступает при давлении, меньшим давления насыщенного пара, т. е. при p∕ps < 1.
Заполнение поры происходит при большем давлении пара в соответствии с соотношением
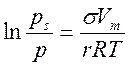 .
.
Конденсация на стенках цилиндрической поры уменьшает диаметр поры, что приводит к ее мгновенному заполнению при давлении, отвечающем началу конденсации. На концах поры образуются сферические мениски жидкости. Десорбция может начаться только при давлении, соответствующем радиусам кривизны этих менисков, т. е. определяемых уравнением Томсона-Кельвина (32). Таким образом, опорожнение капилляра происходит при меньшем давлении, чем его заполнение. Этим объясняется появление петли капиллярно-конденсационного гистерезиса. Так как реальные адсорбенты имеют поры различных форм и размеров, которые заполняются и опорожняются при разных давлениях, то реальные изотермы адсорбции имеют вид, представленный на рис. 27.
Капиллярная конденсация описывается уравнением Томсона-Кельвина, в которое входит радиус кривизны мениска, и это позволяет использовать его для расчета функции распределения пор по размерам. Количественная характеристика дисперсных систем по дисперсности может быть представлена распределением массы, объема, числа частиц по радиусам, поверхности, объемам, массе. Перейти от одного распределения к другому сравнительно просто, особенно если поры или частицы имеют правильную форму. Метод расчета функций распределения частиц (пор) по размерам заключается в построении интегральных и дифференциальных кривых распределения.