Металлы с малой химической активностьювстречаются в природе в свободном состоянии (золото, платина, серебро и т.д.), а остальные металлы получают из руд.
Руды:
· Оксидные ( – бокситная руда),
– бокситная руда),
· Карбонатные ( – магнуит)
– магнуит)
· Силикатные ( – ортоклаз)
– ортоклаз)
· Галидные ( – поваренная соль)
– поваренная соль)
· Сульфидные ( – цинковая обманка)
– цинковая обманка)
Процесс получения металла сводится к процессу восстановления катионов металла до свободного состояния.

Металлургические процессы:
· Пирометаллургические (при  ),
),
· Гидрометаллургические (в растворах).
Пирометаллургические процессы подразделяются на:
1. Карботермия (С, СО):
 ,
,
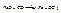 .
.
2. Восстановление водородом:
 .
.
3. Металлотермия:
 (алюмотермия).
(алюмотермия).
4. Термическая диссоциация:
 .
.
5. Электролиз расплавов.
Расплав  .
.
 ,
,
 .
.
№19.
Гидрометаллургия. Гидрометаллургические процессы.
Гидрометаллургия – обработка руд различными растворами.
Гидрометаллургические процессы:
· Восстановление металла из растворов солей более активным металлом.
Медная руда (перевод в раствор):
 ,
,
 , Fe – более активный металл.
, Fe – более активный металл.
· Гидроэлектрометаллургический – оксиды или металлы переводят в раствор (кислота или щёлочь) и раствор подвергают электролизу.
Медная руда
 ,
,
Электролиз:
 ,
,  .
.
№20.
Комплексные соединения. Их строение, номенклатура и диссоциация в растворах.
Комплексные соединения – вещества, в узлах кристаллической решётки которых находятся сложные частицы, построенные за счёт координации одним атомом или ионов электронейтральных молекул или противоположно заряженных ионов способные к самостоятельному существованию в расплавленном или растворённом состоянии.
Строение комплексных соединений (теория Вернера)
1. Комплексообразователь (М) – катионы d -элементов (Ni, Cr и т.д.)
2. Комплексообразователь координирует вокруг себя некоторое число одинаковых или разных лигандов – L.
Лиганды:
· Анионы:
· Простые ( );
);
· Сложные ( );
);
· Нейтральные молекулы:
· Органические ( );
);
· Неорганические (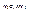 ).
).
Число лигандов непосредственно соединённых с комплексообразователем называется координационным числом.
 , 2, 4, 6, 8 – чаще всего.
, 2, 4, 6, 8 – чаще всего.
Комплексообразователь с лигандами образуют внутреннюю сферу, и она заключается в квадратные скобки:  .
.
В зависимости от заряда центрального иона и лигандов комплексные соединения бывают либо катионными, либо анионными, либо нейтральными.
Комплексные соединения:
· Катионные 
· Анионные 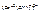
· нейтральные 
Номенклатура комплексные соединений.
Первым называется анион, затем в родительном падеже катион, притом цифры римские, а сами лиганды в порядке увеличения их сложности.
 – сульфат бромопентааммин кобальта (III)
– сульфат бромопентааммин кобальта (III)
 – тетрагидроксодиакваферрат натрия (III).
– тетрагидроксодиакваферрат натрия (III).
Устойчивостькомплексных соединений определяется константой нестойкости. По первой ступени комплексные соединения диссоциируют как сильные электролиты.
 .
.
Дальнейшая диссоциация происходит по типу диссоциации слабых электролитов
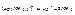 ,
,
 – табличные данные.
– табличные данные.

 .
.
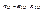 .
.
Чем меньше  , тем устойчивее комплекс.
, тем устойчивее комплекс.
Константа устойчивости:

№21.