Реакции горения протекают при высоких температурах (Т > 1000 К), поэтому они происходят быстро и до конца (т. е. до полного окисления горючего вещества). При горении в основном образуются продукты полного окисления: для углерода - это СО2, для водорода - Н2О, для серы - SО2 и т. д.
При невысоких температурах (Т ~ 500-700 К) между горючим веществом и кислородом может происходить медленная реакция - окисление. Например, метан окисляется до метилового спирта (СН3ОН), который в дальнейшем может окисляться до альдегида (СН2О), а альдегид до муравьиной кислоты (НСООН). Все эти реакции экзотермические (происходят с выделением тепла). Однако скорость выделения тепла в такой реагирующей смеси недостаточна для поддержания температуры реакции (500-700 К). Поэтому для того, чтобы в такой системе происходило окисление, реагирующую смесь необходимо подогревать, т. е. сообщать ей дополнительное количество тепла. Если этого не сделать, то температура реагирующей смеси вследствие теплопотерь понизится до температуры окружающей среды (~300 К) и реакция окисления прекратится. Если же эту систему (смесь метана с кислородом) нагреть до очень высокой температуры (>1000 К), то в ней возникнет качественно другая реакция окисления - реакция горения, которая протекает с большой скоростью, окисление идет сразу до конца (образуются продукты полного окисления), поэтому выделяется максимальное количество тепла, и скорость тепловыделения обеспечивает поддержание в системе высокой температуры. В этом случае реакционную смесь больше подогревать не нужно, собственного тепла достаточно для нагревания этой системы до температуры, при которой происходит химическая реакция горения.
Таким образом, реакция горения, однажды возникнув, в дальнейшем способна сама себя поддерживать. Именно это является отличительной особенностью реакций горения. Пламя, являющееся зоной химических реакций горения, будет существовать до тех пор, пока обеспечивается поступление в эту зону свежих порций горючего и окислителя. С этим связана и способность пламени самопроизвольно распространяться по горючей смеси.
Горение — быстропротекающий окислительно-восстановительный, экзотермический, самоподдерживающийся процесс, часто сопровождающийся образованием пламени.
К такому же типу реакций можно отнести горение пороха и некоторых твердых ракетных топлив.
Горение веществ может происходить не только при их взаимодействии с кислородом, но и при взаимодействии с другими окислителями, такими, как хлор, фтор, окислы азота.
Например, водород и многие углеводороды хорошо горят в атмосфере хлора. При горении водорода происходит реакция образования хлористого водорода:
Н2 + С12 → 2 НС1
Горение в хлоре сопровождается меньшим тепловыделением и происходит с меньшей скоростью, чем в кислороде.
Реже, но встречается и такое горение, при котором имеет место превращение только одного вещества. Примером тому может служить взрывное разложение ацетилена:
СН = СН → 2С (сажа) + Н2
К такому же типу реакций можно отнести горение пороха и некоторых твердых ракетных топлив.
Специалистам, работающим в области пожарной безопасности, приходится в основном иметь дело с горением в атмосфере воздуха, где окислителем является кислород. Именно реакция горючего вещества с кислородом лежит в основе процесса горения, который происходит на пожаре.
Для возникновения горения необходимо образование смеси горючего вещества и окислителя в определенном соотношении и наличие источника зажигания. Условия возникновения горения иллюстрирует треугольник горения:

Классификация видов и режимов горения
1. В зависимости от условий смесеобразования горючих компонентов и соотношения скорости реакции горения и скорости смесеобразования различают два режима горения: кинетический и диффузионный.
Кинетическое горение – процесс горения гомогенной однородной (предварительно перемешанной) горючей смеси.
Скорость кинетического горения определяется скоростью химической реакции, которая, в свою очередь, находится в степенной зависимости от температуры.
В большинстве случаев на реальных пожарах горючее и окислитель предварительно не перемешаны. В этом случае окислитель (кислород воздуха) поступает в пламя из окружающей среды преимущественно за счёт процессов диффузии.
Диффузионное горение — процесс горения неоднородной (предварительно не перемешанной) горючей смеси, в котором существенную роль играют процессы диффузии окислителя к фронту пламени.
Скорость диффузионного горения лимитируется скоростью диффузии окислителя к зоне горения.
В условиях пожара газы, жидкости и твёрдые вещества горят диффузионным пламенем. Структура диффузионного пламени существенно зависит от сечения потока горючих паров и газов и его скорости.
2. В зависимости от механизма распространения зоны горения по горючей смеси различают два характерных режима горения:
дефлаграционное горение — горение, при котором передача тепловой энергии к свежей горючей смеси осуществляется за счет излучения и теплопроводности (скорость движения тепловой волны по горючей смеси от 0,5 до 50 м/с);
детонационное горение — горение, при котором передача тепловой энергии к свежей горючей смеси осуществляется за счет быстрого сжатия, достаточно интенсивного, чтобы довести реагирующую среду до состояния адиабатического воспламенения (без теплообмена с окружающей средой). Скорость движения тепловой волны по горючей смеси более 50 м/с (до нескольких тысяч м/с).
Скорость распространения фронта пламени по газовоздушным смесям может изменяться в пределах от 0,5 до 50 м/с в зависимости от горючего вещества. Скорость распространения пламени зависит не только от скорости химической реакции между горючим и окислителем, но и от скорости передачи тепла от зоны горения в холодную свежую смесь, так как процесс горения представляет собой непрерывное последовательное воспламенение и сгорание все новых и новых порций горючей смеси. Распространение пламени со скоростью движения тепловой волны называется нормальным или дефлаграционным.
При определенных условиях в некоторых горючих смесях, таких, как Н2+О2 (гремучая смесь), С2Н2+О2, С3Н6+О2 и др., может возникнуть совершенно другой режим распространения пламени, когда пламя распространяется не по механизму теплопроводности, а по механизму ударной волны - волны сжатия. В этом случае скорость распространения пламени превышает скорость звука и достигает значений от нескольких сот метров до нескольких километров в секунду. Такое горение называют взрывным или детонационным. Таким образом, по механизму распространения пламени и соответственно по скорости распространения пламени различают дефлаграционное и детонационное горение. Дефлаграционному (нормальному) горению свойственны скорости распространения пламени 0,5-50 м/с, а детонационному (взрывному) горению 500-3000 м/с. Детонационное горение обладает большой разрушительной силой. Однако встречается этот вид горения достаточно редко. Для возникновения детонационного горения даже в системах, склонных к детонации (Н2+О2, С2Н2+О2,...), необходимы специальные условия. Детонация, как правило, возникает в закрытых объемах и длинных трубах, когда создаются условия для ускорения пламени.
3. В зависимости от агрегатного состояния компонентов горючей смеси различают гомогенное и гетерогенное горение.
Во всех рассмотренных примерах горение происходило в газовой фазе, горючее и окислитель в зоне горения находились в одинаковом состоянии - газообразном. Такое горение, при котором оба компонента (горючее и окислитель) в зоне химических реакций находятся в одинаковой фазе, называют гомогенным или однофазным. Если же в зоне горения горючее и окислитель находятся в разных фазах, горение называют гетерогенным (разнофазным).
Гомогенным горением является не только горение газов, но и горение жидкостей, а также большинства твердых горючих материалов. Объясняется это тем, что при горении жидкостей горит не сама жидкость, а ее пары. В результате испарения с поверхности жидкости непрерывно в газовую фазу поступают пары горючего вещества, которые, смешиваясь с окружающим воздухом, образуют горючую паровоздушную смесь. Именно здесь в паровоздушной смеси, а не на поверхности жидкости будут происходить химические реакции горения. Визуально можно наблюдать, что пламя (зона горения) как бы немного оторвано от поверхности жидкости.
Похожая картина наблюдается и при горении большинства твердых горючих материалов: парафина, оргстекла, полиэтилена, древесины, торфа, хлопка, резины, различных пластмасс. На их поверхности под воздействием тепловых потоков могут происходить различные физикохимические процессы (плавление, испарение, термическое разложение). В результате образуются газообразные горючие вещества, которые и вступают в химическую реакцию горения с кислородом воздуха. Таким образом, и в случае твердых горючих материалов горючее вещество и окислитель в зоне горения оказываются в одной фазе, в одном агрегатном состоянии. Поскольку химические реакции горения происходят в газовой фазе, то над поверхностью твердого горючего материала наблюдается пламя. Наличие пламени является отличительным признаком гомогенного горения.
Примером гетерогенного горения может служить горение углерода (графит или углистый остаток после термического разложения древесины), который даже при высоких температурах остается в твердом состоянии. Кислород воздуха диффундирует к твердой поверхности и при достаточно высокой температуре (700-800°С) на поверхности будет происходить химическая реакция между твердым углеродом и газообразным кислородом. Пламя в этом случае отсутствует, а признаком гетерогенного горения углерода будет являться ярко красное свечение поверхности углерода. Такое горение называется тлением. Некоторые твердые горючие материалы, способные к гомогенному горению, такие, как древесина, бумага, хлопок и др., могут тлеть в случае, если количество теплоты, поступающее к поверхности этого материала, мало для обеспечения интенсивного термического разложения материала с образованием газообразных горючих веществ. При гетерогенном горении существует поверхность раздела фаз (твердой и газовой), именно на поверхности раздела фаз и происходят химические реакции. Гетерогенное горение является диффузионным, так как прежде чем произойдет химическая реакция между горючим и окислителем необходимо, чтобы кислород продиффундировал к поверхности раздела фаз, которая в данном случае и является зоной горения.
Гомогенное горение — процесс взаимодействия горючего и окислителя, находящихся в зоне химической реакции в одинаковом агрегатном состоянии.
Примером гомогенного горения является горение горючих газов и паров жидкостей, газообразных продуктов термического распада большинства твёрдых горючих веществ, а в ряде случаев пылевого аэрозоля в среде газообразного окислителя. При этом горючее и окислитель в зоне химической реакции перемешаны и не имеют поверхности раздела.
Гетерогенное горение — процесс взаимодействия горючего и
окислителя, находящихся в различных агрегатных состояниях, горение происходит на поверхности раздела фаз.
Особенностью гетерогенного горения является отсутствие пламени. Беспламенное горение называют тлением. Примерами являются горение антрацита, кокса, древесного угля, нелетучих металлов. При гетерогенном горении кислород (или другой газообразный окислитель) диффундирует сквозь продукты сгорания к поверхности горючего вещества, а затем вступает с ним в химическую реакцию.
4. По газодинамическим параметрам различают ламинарное и турбулентное горение (пламя).
Ламинарное горение — процесс, при котором массообмен и перенос тепла происходят путем молекулярной диффузии и возникающих конвективных потоков окислителя и горючего вещества к зоне химической реакции. При этом наблюдается спокойное, безвихревое пламя устойчивой геометрической формы.
Турбулентное горение — процесс, при котором массообмен и перенос тепла осуществляются не только за счет молекулярной, но и турбулентной диффузии, в результате макроскопического вихревого движения газовых слоев горючей смеси.
Газодинамический режим горения зависит от линейной скорости горючего вещества или смеси и характеризуется критерием Рейнольдса (мера отношения сил инерции и внутреннего трения в потоке):
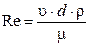 , (1.1)
, (1.1)
где υ – линейная скорость газового потока, м/с;
d – диаметр, м;
ρ – плотность потока, кг/м3;
μ – динамическая вязкость, Н·с/м2.
При Re < 2300 режим горения ламинарный, при 2300 < Re < 10000 – переходный, при Re > 10000 – турбулентный.
Гомогенное, диффузионное горение образовано потоком горючего газа, втекающим в окислительную среду. В зависимости от скорости потока, его диаметра и вязкости среды движение может быть ламинарным или турбулентным. Также и возникающее диффузионное пламя может быть ламинарным или турбулентным. Ламинарное пламя образуется при низких скоростях потока горючего и небольшом его диаметре. Ламинарное горение воспринимается как спокойное горение, когда пламя неподвижно относительно окружающей среды. Такое пламя можно наблюдать при горении свечи, при горении газа в горелке, если скорость истечения небольшая, а также при горении жидкости в небольших тиглях.
С увеличением скорости и диаметра потока газообразного горючего вещества происходит его турбулизация, появляются завихрения, пламя становится неустойчивым. Турбулизация пламени приводит к увеличению скорости смесеобразования и, как следствие, к увеличению скорости горения.
Развитый турбулентный режим горения наблюдается на пожарах газовых фонтанов, крупных резервуаров с горючими жидкостями, больших штабелей древесины.
Ламинарный и турбулентный режимы горения характерны как для диффузионного, так и для кинетического пламени. При ламинарном кинетическом горении фронт пламени гладкий, движение его спокойное. При турбулизации кинетического горения происходит искривление фронта, образуются вихри и фронт разбивается на отдельные очаги. При этом скорость горения увеличивается, увеличивается и скорость движения зоны горения. Турбулизации кинетического горения и его ускорению способствует наличие препятствий на пути движения фронта. Так, кинетическое пламя хорошо турбулизуется и ускоряется в загроможденных помещениях. Турбулизация и ускорение кинетического пламени может способствовать переходу дефлаграционного горения в детонацию.
5. В зависимости от объёма окислителя, давления и температуры, горение вещества может быть полным и неполным.
При полном сгорании веществ образуются продукты, не способные к дальнейшему взаимодействию (СО2, Н2О, НСl).
При неполном сгорании образуются продукты, способные к дальнейшему горению (СО, НСN, NН3).
В условиях пожара при горении органических веществ на воздухе чаще всего полного сгорания не происходит. Признаком неполного сгорания является наличие дыма, содержащего несгоревшие частицы углерода.
Пламя
Горение большинства горючих веществ сопровождается появлением пламени. Пламя образуется при горении тех веществ, которые при разложении, испарении или окислении выделяют горючие газы и пары, которые при горении нагреваются и светят.
Пламя — это газовый объём, в котором непосредственно происходит реакция горения. Пламя выделяет лучистую теплоту, а также конвективный поток теплоты и газов. Наиболее высокотемпературная поверхность пламени, где протекают окислительно-восстановительные процессы, называется реакционной зоной или фронтом пламени.
Накаленные пары и газы сами по себе светят мало и поэтому горение, например, водорода, этилового спирта, сопровождается бледным пламенем. Бледное пламя можно сделать светящимся, внося в него мелкие частицы твердых тел. Так, например, если в бледное пламя горения спирта или в пламя горения водорода поместить самую тонкую платиновую проволоку, то она будет ярко светить. Такой же эффект достигается, если в бледное пламя поместить тонкий порошок песка или в пламя ввести сетку, покрытую окислами, например, церия. В ярком пламени содержатся какие-либо твердые частицы или, по крайней мере, очень плотные тяжелые пары. Пламя горящей свечи, дерева, парафина и т. п. веществ яркое потому, что в этом пламени находятся частицы продуктов осмоления и угля, получающиеся в результате пиролиза вещества при горении.
Практически без пламени горят графит, кокс, древесный уголь и ряд других веществ потому, что они при горении не выделяют горючих газообразных продуктов. Наблюдаемое при горении этих веществ бледное синее пламя есть результат догорания угарного газа (СО). Вот почему нельзя закрывать трубу печи до тех пор, пока не прекратится синее бледное пламя, хорошо заметное в темноте, иначе помещение наполняется окисью углерода (II), газом весьма опасным для жизни животных и людей.
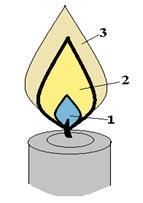
Пары и газы, выделяющиеся при горении горючих веществ, как правило, не содержат свободного кислорода и для горения им необходим кислород воздуха, который проникает к месту горения путем диффузии, поэтому пламя имеет определенное строение. На рисунке 1.1 приводится примерная схема диффузионного пламени, на примере пламени свечи:

| 
|
| Рис. 1.1. Схема диффузионного пламени (на примере пламени свечи). |
Внутренняя зона (1) заполнена парами и продуктами разложения, выделяющимися из горючего вещества в результате его нагревания. Количество диффундирующего из окружающего воздуха кислорода в этой зоне мало и температура сравнительно невысока. На фотографии хорошо видно, что первая зона имеет характерный окрас, усиливающийся к краям зоны, что связано с тем что в этой зоне происходит неполное горение с образованием СO, являющимся источником синеватого окраса. По мере приближения к краям зоны количество диффундирующего кислорода увеличивается, и горение идет более интенсивно, что хорошо заметно по усилению окраса.
В зоне (2), куда частично, проникает кислород воздуха, происходит окисление паров и продуктов разложения, но вследствие недостаточности кислорода именно в этой зоне происходит осмоление и образование мелких частиц угля и поэтому эта зона ярко светится (напомним, что свечение пламени обусловлено наличием в пламени взвешенных частиц твердой фазы). Температура в этой зоне значительно выше, чем в зоне (1).
В зоне (3) происходит догорание продуктов, образовавшихся уже в зоне (2), и частично тех паров и продуктов разложения, которые не успели прореагировать в зоне (2). Зона (3) содержит самое большое количество диффундировавшего кислорода, т.к. она является самой внешней и имеет наибольшую поверхность. При достаточном количестве кислорода происходит полное окисление паров до газообразных продуктов, поэтому именно в этой зоне выделяется наибольшее количество тепла. Температура в этой зоне еще выше, чем в зоне (2), но яркости пламени уже нет, т.к. в зоне почти отсутствуют частицы недогоревшей твердой фазы.
Зона горения в диффузионном пламени представляет собой очень тонкий слой, в котором протекает реакция горения. Толщина этого слоя порядка 0,1 — 1,0 мм.
Характер свечения пламени зависит от состава горючего вещества (главным образом от процентного соотношения углерода и кислорода, таблица 1.1.).
Таблица 1.1.
Характер свечения пламени в зависимости от состава горючего вещества.
| Характер свечения пламени | Содержание кислорода в горючем веществе, % | Содержание углерода в горючем веществе, % |
| Пламя бесцветное | Более 30 | До 50 |
| Пламя яркое, не коптящее | Отсутствует или менее 30 | Не более 75 |
| Пламя яркое, коптящее | Отсутствует или менее 25 | Более 75 |
Как уже отмечалось выше, свечение пламени связано с наличием несгоревших раскалённых твёрдых частиц углерода. При термическом разложении веществ с массовой долей углерода менее 50 % и содержащих в своём составе кислород (более 30 %) несгоревших частиц углерода образуется очень мало, и в момент образования они успевают окислиться до СО или СО2. Такие вещества имеют бесцветное пламя. При горении веществ, содержащих более 75 % углерода (бензол, керосин), в зоне горения образуется настолько много частиц углерода, что поступающего путём диффузии в зону горения воздуха не хватает для его полного окисления. Не окислившийся в пламени углерод выделяется в виде копоти, и пламя при горении таких веществ будет ярким коптящим.
Процентное содержание элементов рассчитывают по формуле:

где А – атомный вес элемента,
n – число атомов данного элемента в формуле горючего вещества,
 молекулярная масса горючего вещества
молекулярная масса горючего вещества