В почвах может происходить более 30 различных химических реакций и процессов. Часть их них имеет общий характер для всех почв, часть присуща только отдельным почвенным типам. Общие для большинства почв реакции следующие: осаждение-растворение, катионный обмен, комплексообразование, синтез и минерализация органических соединений, образование гуминовых веществ. Почвам северных влажных регионов свойственны накопление кислых продуктов, развитие восстановительных процессов (глееобразование); в сухих южных районах нередко происходит накопление солей, а реакция почв зависит от карбонатов кальция и регулируется карбонатно-кальциевым равновесием. Ниже рассмотрены наиболее важные для почв реакции.

Катионный обмен. Эту реакцию в 1850 - 1852 гг. открыли английские ученые - фермер Томпсон и химик Уэй. В 1922 - 1925 гг. на этой основе советский почвовед академик К.К. Гедройц создал стройное учение о поглотительной способности почв, получившее признание во всем мире [5]. После открытия анионного обмена была создана общая теория ионного обмена, налажено промышленное производство ионитов (ионообменных сорбентов), разработаны методы ионообменной хроматографии. Для почв наиболее характерны реакции катионного обмена между твердой частью почвы, которая поглощает катионы, и почвенным раствором, который можно рассматривать как раствор электролита. Если твердую часть почвы обозначить символом П, как это принято в почвенной литературе, то при добавлении к почве раствора KCl произойдет реакция
ПCa, Mg + 4KCl П  + Ca
+ Ca 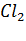 + Mg
+ Mg 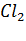 .
.
Это означает, что почва содержала в обменной форме 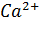 и
и  , которые были вытеснены в раствор, а ионы
, которые были вытеснены в раствор, а ионы  были поглощены почвой. Каких-либо других изменений при этом в почве не происходит.
были поглощены почвой. Каких-либо других изменений при этом в почве не происходит.
В дерново-подзолистых почвах таежных лесов в обменной форме присутствуют ионы 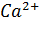 ,
,  ,
, 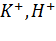 ,
, 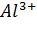 . В черноземах, каштановых почвах степей преобладают
. В черноземах, каштановых почвах степей преобладают 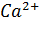 ,
,  ,
,  В солонцах и некоторых солончаках, кроме того, обычно есть Na+.
В солонцах и некоторых солончаках, кроме того, обычно есть Na+.
Общее количество обменных катионов в почве, согласно Международной системе единиц СИ, измеряют в смол (+) * 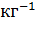 (сантимоли положительных зарядов в 1 кг почвы) и называют емкостью катионного обмена (сокращенно ЕКО). Абсолютные величины EKO колеблются от единиц до нескольких десятков смол (+) *
(сантимоли положительных зарядов в 1 кг почвы) и называют емкостью катионного обмена (сокращенно ЕКО). Абсолютные величины EKO колеблются от единиц до нескольких десятков смол (+) * 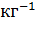 . Эти реакции очень важны, поскольку от состава обменных катионов и их количества зависят почвенное плодородие, многие физические и химические свойства почв и способность противостоять химическому загрязнению почв.
. Эти реакции очень важны, поскольку от состава обменных катионов и их количества зависят почвенное плодородие, многие физические и химические свойства почв и способность противостоять химическому загрязнению почв.
 Кислотность почв. Обменные катионы участвуют также в формировании потенциальной кислотности почв. Такая кислотность встречается в кислых дерново-подзолистых, серых лесных, красноземных почвах. Проявляется она только при воздействии на почву солевого раствора, так же как и при обычной реакции катионного обмена. Отличие состоит в том, что потенциальная кислотность обусловлена только катионами
Кислотность почв. Обменные катионы участвуют также в формировании потенциальной кислотности почв. Такая кислотность встречается в кислых дерново-подзолистых, серых лесных, красноземных почвах. Проявляется она только при воздействии на почву солевого раствора, так же как и при обычной реакции катионного обмена. Отличие состоит в том, что потенциальная кислотность обусловлена только катионами  и
и 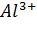 :
:
П  + KCl П
+ KCl П 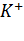 + HCl или
+ HCl или
P 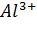 + 3KCl П
+ 3KCl П  + Al
+ Al  П
П  + Al
+ Al 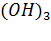 + 3HCl.
+ 3HCl.
И в том и в другом случае в растворе появляется некоторое количество HCl, что и создает кислую реакцию среды.[4]
Устраняют потенциальную кислотность довольно простыми приемами. Обычно к почве добавляют карбонат кальция (известь), который нейтрализует различные формы кислотности:
П 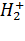 + CaC
+ CaC 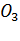 П
П 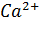 +
+ 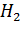 C
C 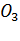 П
П 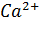 + C
+ C  +
+ 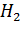 O.
O.
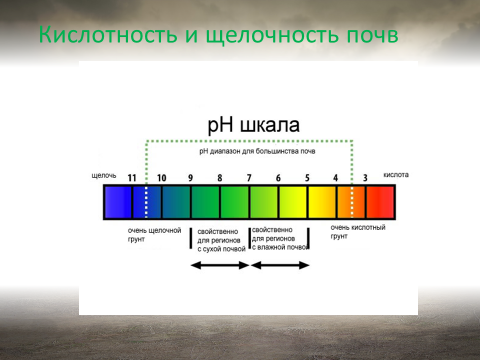
Природная кислотность почв может быть вызвана органическими кислотами, попадающими в почву с растительными остатками или корневыми выделениями, диоксидом углерода в почвенном воздухе и поступлением азотной и серной кислот с кислыми дождями. Анализ химических равновесий показал, что роль C  в этом процессе более значительна, чем это представлялось раньше [3]. Растворение C
в этом процессе более значительна, чем это представлялось раньше [3]. Растворение C 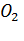 приводит к образованию угольной кислоты
приводит к образованию угольной кислоты 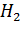 C
C 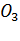 . Сама по себе это довольно слабая кислота, но в почвенном воздухе доля C
. Сама по себе это довольно слабая кислота, но в почвенном воздухе доля C  много выше, чем в атмосферном; в последнем доля составляет около 0,03%, а в почвенном воздухе достигает целых процентов. Поэтому в некарбонатных почвах только за счет C
много выше, чем в атмосферном; в последнем доля составляет около 0,03%, а в почвенном воздухе достигает целых процентов. Поэтому в некарбонатных почвах только за счет C 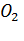 величина pH может опускаться до 4,5 и даже ниже.
величина pH может опускаться до 4,5 и даже ниже.
Щелочность почв. Щелочными считают почвы, водная суспензия которых имеет рН 7,5 - 8,0 или выше. Эти почвы формируются в степных и сухостепных природных зонах; к ним относятся солонцы, некоторые солончаки. Щелочность вызывается различными солями: карбонатами, фосфатами, боратами, гуматами, силикатами. Но главную роль играют 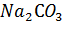 и CaC
и CaC 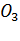 , последний создает кислотно-основную буферность и сравнительно высокую щелочность.[3] Регулирование реакции осуществляется в этом случае за счет карбонатно-кальциевой системы CaC
, последний создает кислотно-основную буферность и сравнительно высокую щелочность.[3] Регулирование реакции осуществляется в этом случае за счет карбонатно-кальциевой системы CaC 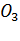 -
- 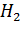 O-C
O-C  . Карбонат кальция присутствует в твердой части почвы, вода в почве имеется почти всегда (за исключением сильных засух), а C
. Карбонат кальция присутствует в твердой части почвы, вода в почве имеется почти всегда (за исключением сильных засух), а C 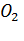 всегда есть в почвенном воздухе. Почвенный раствор такой системы содержит разные количества
всегда есть в почвенном воздухе. Почвенный раствор такой системы содержит разные количества 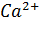 ,
, 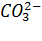 ,
, 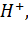
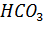 и величина рН регулируется, по сути, только парциальным давлением C
и величина рН регулируется, по сути, только парциальным давлением C  . Эта система работает до тех пор, пока в твердой части почвы присутствует CaC
. Эта система работает до тех пор, пока в твердой части почвы присутствует CaC 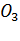 , и обусловливает величины рН почвенных суспензий до 7,5 - 10,0 в зависимости от парциального давления в почвенном воздухе.
, и обусловливает величины рН почвенных суспензий до 7,5 - 10,0 в зависимости от парциального давления в почвенном воздухе.
Щелочность почв неблагоприятно сказывается на их химических и физических свойствах. Под действием щелочной среды почвы расплываются, теряют структурность, а затем при высыхании сливаются в плотные, очень прочные глыбы, которые часто не поддаются действию плуга. Таковы солонцы в зонах черноземных, каштановых и бурых почв.
Засоление почвы. В бессточных впадинах сухих регионов страны, в приморских районах почвы нередко содержат высокие концентрации легкорастворимых солей. Это хлориды кальция, магния, натрия и калия, сульфаты, некоторые карбонаты, нитраты. Легкорастворимые соли отрицательно сказываются на развитии растений, поскольку они повышают осмотическое давление почвенных растворов, а некоторые катионы и анионы токсичны для растений. Засоленных почв особенно много в Предкавказье, в Прикаспийской низменности, в Средней Азии. К счастью, легкорастворимые соли сравнительно легко подвижны, и их довольно просто удалить из почвы путем обычного промывания водой. В щелочных почвах неблагоприятные вещества сначала нейтрализуют гипсом, отработанной серной кислотой, сульфатами железа, а затем образующиеся легкорастворимые соли также отмывают водой. Этот метод мелиорации засоленных почв очень широко распространен, но успех приема зависит от возможности удаления промывных вод. В противном случае промывные воды смыкаются с подземными грунтовыми водами, повышая их уровень. В результате возникает опасность вторичного засоления почв за счет поднимающихся к поверхности соленых грунтовых вод по окраинам орошаемых и промываемых массивов.[2]
 Окислительно-восстановительные режимы. Практически в каждой почве происходят реакции окисления или восстановления химических соединений или элементов. Эти реакции являются сопряженными, и если какой-либо компонент почвы окисляется, то другой неизбежно восстанавливается. Наиболее простой и распространенный вариант - окисление-восстановление ионов железа:
Окислительно-восстановительные режимы. Практически в каждой почве происходят реакции окисления или восстановления химических соединений или элементов. Эти реакции являются сопряженными, и если какой-либо компонент почвы окисляется, то другой неизбежно восстанавливается. Наиболее простой и распространенный вариант - окисление-восстановление ионов железа:
Окислительные процессы идут за счет кислорода воздуха, при этом органические вещества почвы окисляются или частично, или полностью до конечных продуктов распада - 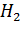 O и C
O и C  . При высоких окислительно-восстановительных потенциалах порядка 0,5 - 0,7В практически все элементы с переменной валентностью приобретают высшие степени окисления, многие из них становятся малоподвижными и малодоступными растениям. Таковы ионы железа, меди, кобальта, серы, азота. Исключение составляет марганец, для перевода которого из
. При высоких окислительно-восстановительных потенциалах порядка 0,5 - 0,7В практически все элементы с переменной валентностью приобретают высшие степени окисления, многие из них становятся малоподвижными и малодоступными растениям. Таковы ионы железа, меди, кобальта, серы, азота. Исключение составляет марганец, для перевода которого из 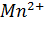 в
в 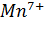 необходимы потенциалы около 1,4 - 1,5 В, тогда как даже в наиболее аэрированных и малоувлажненных почвах максимальные значения потенциалов редко превышают 0,6 - 0,7 В.
необходимы потенциалы около 1,4 - 1,5 В, тогда как даже в наиболее аэрированных и малоувлажненных почвах максимальные значения потенциалов редко превышают 0,6 - 0,7 В.
В переувлажненных почвах, особенно в затопляемых рисовых почвах, развиваются восстановительные процессы, потенциалы снижаются до + 0,2 / - 0,2 В, что обусловлено деятельностью микроорганизмов, способных развиваться без доступа свободного 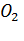 и выделяющих в почву органические восстановленные соединения и свободный водород. В таких почвах элементы с переменной валентностью переходят в состояние низших степеней окисления, становятся подвижными, выделяется метан C
и выделяющих в почву органические восстановленные соединения и свободный водород. В таких почвах элементы с переменной валентностью переходят в состояние низших степеней окисления, становятся подвижными, выделяется метан C 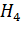 , другие углеводороды. Когда длительно развиваются восстановительные процессы, в почвах появляется сизоватая окраска, железо и марганец восстанавливаются до
, другие углеводороды. Когда длительно развиваются восстановительные процессы, в почвах появляется сизоватая окраска, железо и марганец восстанавливаются до  и
и  . Такие почвы называют оглеенными или глеевыми. Кстати, переувлажненные или орошаемые и затопляемые почвы служат одним из важнейших природных источников выделения в атмосферу метана и других углеводородов, вызывающих проявления "парникового" эффекта.
. Такие почвы называют оглеенными или глеевыми. Кстати, переувлажненные или орошаемые и затопляемые почвы служат одним из важнейших природных источников выделения в атмосферу метана и других углеводородов, вызывающих проявления "парникового" эффекта.
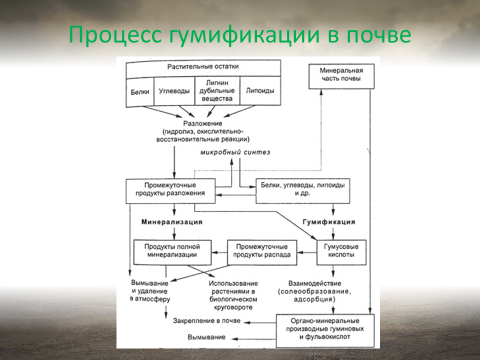 Гумификация. Это один из самых важных почвенных биохимических процессов. Сущность его заключается в трансформации растительных остатков в своеобразные, темноокрашенные органические гуминовые вещества преимущественно кислотной природы. Впервые гуминовые кислоты выделил из торфа немецкий ученый Ф. Ахард в 1786 г., но до сих пор их строение остается неясным. В основе гуминовых веществ лежат бензолсодержащие фрагменты, их мобильная часть представлена большим набором аминокислот и моносахаридов, они содержат азот и различные кислородсодержащие функциональные группы: карбоксильные -COOH, гидроксильные -OH, хинонные и другие. Особенность гуминовых веществ заключается в высокой устойчивости к гидротермическим и биохимическим условиям; их возраст, датированный по
Гумификация. Это один из самых важных почвенных биохимических процессов. Сущность его заключается в трансформации растительных остатков в своеобразные, темноокрашенные органические гуминовые вещества преимущественно кислотной природы. Впервые гуминовые кислоты выделил из торфа немецкий ученый Ф. Ахард в 1786 г., но до сих пор их строение остается неясным. В основе гуминовых веществ лежат бензолсодержащие фрагменты, их мобильная часть представлена большим набором аминокислот и моносахаридов, они содержат азот и различные кислородсодержащие функциональные группы: карбоксильные -COOH, гидроксильные -OH, хинонные и другие. Особенность гуминовых веществ заключается в высокой устойчивости к гидротермическим и биохимическим условиям; их возраст, датированный по  , достигает сотен и тысяч лет, а молекулярные массы составляют десятки тысяч атомных единиц массы. Функции гуминовых веществ в почвах разнообразны и чрезвычайно важны. Они аккумулируют элементы питания растений, защищают почвенные минералы от выветривания, способствуют миграции катионов различных металлов в форме комплексных соединений, регулируют тепловой и кислотно-основной режимы почв, влияют на емкость катионного обмена и на буферность почвы, обладают выраженной физиологической активностью и способны стимулировать рост и развитие сельскохозяйственных растений. Гуминовые кислоты и их соли (гуматы) получают из различного природного сырья и используют не только в сельском хозяйстве, но также в промышленности и медицине.
, достигает сотен и тысяч лет, а молекулярные массы составляют десятки тысяч атомных единиц массы. Функции гуминовых веществ в почвах разнообразны и чрезвычайно важны. Они аккумулируют элементы питания растений, защищают почвенные минералы от выветривания, способствуют миграции катионов различных металлов в форме комплексных соединений, регулируют тепловой и кислотно-основной режимы почв, влияют на емкость катионного обмена и на буферность почвы, обладают выраженной физиологической активностью и способны стимулировать рост и развитие сельскохозяйственных растений. Гуминовые кислоты и их соли (гуматы) получают из различного природного сырья и используют не только в сельском хозяйстве, но также в промышленности и медицине.
Таким образом, подводя общие итоги, можно сделать некоторые выводы о химическом составе и причинах химической устойчивости почв.
1. Любая почва имеет очень сложный химический состав как по набору и количественному соотношению химических элементов, так и по формам их соединений.
2. Наиболее активную химическую роль в почвах играют те вещества, которые находятся в высокодисперсном состоянии (ил, плазма); к ним относятся гуминовые вещества, слоистые глинистые минералы, ионные и молекулярные дисперсии.
3. Для почв характерно образование и накопление специфических гуминовых веществ, главных и наиболее активных составляющих органического вещества почвы.
4. В почвах одновременно протекает множество реакций, зачастую противоположно направленных, что обусловливает стабильность системы; многообразие химических соединений и реакций - главное условие устойчивости почв.
5. В каждой природной зоне формируются почвы, имеющие особый химический состав и режимы, хорошо согласованные с экологической обстановкой или, по В.В. Докучаеву, соответствующие факторам почвообразования.[1]
