Существует много хорошо разработанных методов выращивания кристаллов [3], [4], [7]. Простейший метод состоит в испарении раствора при постоянной, например, комнатной, температуре. Для этого берут некоторое количество кристаллического вещества и растворяют его при сильном нагревании в воде, в таком её количестве, чтобы по охлаждении получился насыщенный раствор. В раствор, пока он ещё не охладился до комнатной температуры, помещают небольшой готовый кристалл такой величины, чтобы он не успел раствориться при дальнейшем охлаждении раствора до комнатной температуры. Поместив сосуд с раствором в закрытый сосуд, содержащий какое-либо поглощающее влагу вещество (серную кислоту, фосфорный ангидрид и т.д.), оставляют прибор в покое на длительное время. При испарении раствора будет возникать пересыщение, за счёт которого и будет происходить рост кристалла.

Рис. 2. Прибор для выращивания кристаллов из раствора испарением (эксикатор).
Нижняя ёмкость для серной кислоты
Можно получать большие кристаллы также и путём медленного охлаждения раствора. Для этого необходимо иметь термостат, т.е. прибор, который может автоматически поддерживать определённую температуру и с помощью которого можно также постепенно снижать её по определённому графику. Опыт ведётся таким образом, что сначала приготовляется раствор, насыщенный при начальной температуре термостата. В раствор помещается затравка в виде готового кристалла или его части. Можно подвесить затравки на тонких ниточках (к нити их можно приклеить прочным водостойким клеем). Кристаллизационный сосуд закрывается крышкой, чтобы предотвратить попадание в него зародышей, в качестве которых выступают частицы пыли, из воздуха, после чего включаются приспособления для постепенного охлаждения термостата.
Можно выращивать кристаллы также из заранее приготовленного пересыщенного раствора при постоянной температуре. Для этого приготавливается при сильном нагревании такой раствор, чтобы после охлаждения до заданной температуры он имел заранее вычисленное пересыщение. В раствор помещается затравка, и сосуд, содержащий раствор, закрывается крышкой. Затравка представляет собой небольшой кристалл того же вещества, что и раствор. Этим методом можно получить большие кристаллы лишь при употреблении значительных количеств раствора.
Квасцы являются изоморфными веществами, т.е. они кристаллизуются одинаково, несмотря на разный состав. Это свойство квасцов позволяет получить смешанные кристаллы. Для этого нужно приготовить насыщенные растворы квасцов двух видов и некоторое время выращивать кристаллы по одному из описанных выше методов — каждый вид в своём сосуде, затем поменять кристаллы местами так, чтобы кристалл одного вида квасцов находился в насыщенном растворе квасцов другого вида.
Кристаллы квасцов, выращенные до нужных размеров, следует покрыть лаком, чтобы они не оплавились от влаги воздуха и не потеряли форму.
Растворы для выращивания кристаллов готовят на дистиллированной воде.
Методики получения квасцов
Алюмокалиевые квасцы K2SO4 · Al2(SО4)3 · 24Н2О обычно получают при взаимодействии избытка алюминия с теплым раствором гидроксида калия до прекращения выделения водорода. После декантации и нейтрализации раствора разбавленной серной кислотой его оставляют для кристаллизации [10].
Хромокалиевые квасцы K2SO4 · Cr2(SО4)3 · 24Н2О обычно получают при взаимодействии раствора двухромовокислого калия с концентрированной серной кислотой. После охлаждения раствора в воде со льдом с него по каплям добавляют спирт. Раствор упаривают и оставляют кристаллизоваться. [11]
Мы в работе используем более простую методику – прямое получение квасцов сокристаллизацией сульфатов при сливании растворов.
Экспериментальная часть
1. Получение железокалиевых квасцов — KFe(SO4)2 · 12H2O
K2SO4 + Fe2(SO4)3 + 24H2O = 2KFe(SO4)2 · 12H2O
Таблица 4. Растворимость сульфатов калия и железа (III)
| Вещество | Количество воды (мл) | Условия (температура в ° С) | Количество вещества | |
| в г | в моль | |||
| K2SO4 | 2,22 | 0,01276 | ||
| Fe2(SO4)3 | 16,30 | 0,04075 |
Так как растворимость сульфата калия в моль/л меньше растворимости сульфата железа (III), дальнейшие расчёты производятся относительно количества сульфата калия. При 80оС растворимость сульфата калия равна 21,4 г / 100 г воды [8]. Сульфат железа взят в эквимолярном количестве.
Таблица 5. Взятые количества сульфатов калия и железа (III)
| Вещество | Количество воды (мл) | Условия (температура в ° С) | Количество вещества | |
| в г | в моль | |||
| K2SO4 | 4,28 | 0,02460 | ||
| Fe2(SO4)3 | 9,84 | 0,02460 |
В качестве источника сульфата железа используется кристаллогидрат Fe2(SO4)3 · 9H2O массой: 400·0,02460 + 162·0,02460 = 13,8252 г.
М(Fe2(SO4)3)=400; М(9·H2O)=162 г/моль.
В результате растворения этого количества кристаллогидрата сульфата железа образуется 4 мл воды, поэтому кристаллогидрат растворен в 16 мл воды, чтобы объём раствора составил 20 мл. Сульфат калия растворен в 20 мл воды.
Растворы сульфата калия и сульфата железа (III) были приготовлены в разных колбах. Раствор Fe2(SO4)3 подкислен концентрированной серной кислотой, чтобы предотвратить гидролиз иона Fe3+, протекающий по уравнению:
Fe3+ + H2O  FeOH2+ + H+.
FeOH2+ + H+.
При добавлении ионов Н+ равновесие гидролиза смещается в сторону Fe3+.
Растворы нагревали до полного растворения солей, затем слили растворы в одну колбу и оставили остывать при комнатной температуре.
Наличие катионов Fe3+ проверялось качественной реакцией взаимодействия с роданид-анионом SCN-, при этом образуется роданид железа (III) Fe(SCN)3, окрашивающий раствор в темно-красный цвет (эффект «крови»):
Fe3+ + 3SCN− = Fe(SCN)3
2. Получение железоцезиевых квасцов — CsFe(SO4)2 · 12H2O
Cs2SO4 + Fe2(SO4)3 + 24H2O = 2CsFe(SO4)2 · 12H2O
Перед началом получения железоцезиевых квасцов необходимо получить сульфат цезия из иодата цезия:
2CsIO3 + H2SO4 = Cs2SO4 + 2HIO3
На 15,15 г (2·0,02460 моль) иодата цезия берётся эквивалентное количество концентрированной серной кислоты (1,31 мл). Кислота была взята с небольшим избытком. Для проведения реакции иодат цезия был растворен в 70 мл воды, после чего в раствор прилита концентрированная серная кислота. Реакция проводилась при нагревании. Так как иодат цезия обладает невысокой растворимостью в воде, прилили ещё 130 мл воды, таким образом, объём раствора составил 200 мл.
Таблица 7. Взятые количества кристаллогидрата сульфата железа (III) и иодата цезия
| Вещество | Количество воды (мл) | Условия (температура в ° С) | Количество вещества | |
| в г | в моль | |||
| CsIO3 | 15,15 | 0,04920 | ||
| Fe2(SO4)3 · 9H2O | 13,83 | 0,02460 |
Кристаллогидрат сульфата железа (III) растворили в 16 мл воды, раствор подкислили (подробнее о приготовлении раствора сульфата железа (III) написано в пункте 1 «Получение железокалиевых квасцов — KFe(SO4)2 · 12H2O»).
Растворы сульфата цезия и сульфата железа (III) нагревали при постоянном помешивании до полного растворения солей, затем оба раствора слили в одну колбу. После сливания двух растворов сразу выпал осадок светло-зелёного цвета, который был отфильтрован и оставлен для дальнейшего изучения. Отфильтрованный раствор был оставлен кристаллизоваться.
3. Получение эрбийкалиевых квасцов — KEr(SO4)2 · 12H2O
K2SO4 + Er2(SO4)3 + 24H2O = 2KEr(SO4)2 · 12H2O
Перед началом получения эрбийкалиевых квасцов необходимо было получить сульфат эрбия из оксида эрбия:
Er2O3 + 3H2SO4 = Er2(SO4)3 + 3H2O.
На 4,91 г (0,01285 моль) оксида эрбия, согласно уравнению реакции, взято 3,78 г (3·0,01285 моль) концентрированной серной кислоты, что составляет 2 мл. Для проведения реакции в колбу с оксидом эрбия приливается 10 мл воды, чтобы образующийся сульфат эрбия растворялся (оксид эрбия нерастворим в воде). Затем в колбу медленно приливается концентрированная серная кислота. По уравнению реакции, количество полученного сульфата эрбия Er2(SO4)3 составляет 8 г. Для полного растворения сульфата эрбия в раствор приливали 280 мл воды, чтобы объём составил 300 мл, затем раствор оставили охлаждаться в холодильнике. Данные по растворимости сульфата эрбия в литературе отсутствовали. Было сделано предположение, что растворимость сульфата эрбия увеличивается при уменьшении температуры, как у других лантаноидов (Таблица 6) что в ходе работы экспериментально подтвердилось.
Таблица 6. Растворимость некоторых сульфатов редкоземельных металлов в воде [9]
| Pr2(SO4)3 | Nd2(SO4)3 | Yb2(SO4)3 | |||
| Массовая доля | Температура в ° С | Массовая доля | Температура в ° С | Массовая доля | Температура в ° С |
| 16,5 | 11,5 | 30,65 | |||
| 13,5 | 8,8 | 25,70 | 15,5 | ||
| 11,2 | 6,6 | 16,03 | |||
| 10,0 | 5,8 | 10,31 | |||
| 9,0 | 5,0 | 9,42 | |||
| 7,2 | 3,9 | 6,73 | |||
| 6,0 | 3,2 | 6,47 | |||
| 4,8 | 2,7 | 5,51 | |||
| 4,0 | 2,4 | 4,46 | |||
| 3,4 | 2,0 | ||||
| 1,1 | 1,2 | ||||
| 0,9 | 1,15 | ||||
| 1,2 |
| Y2(SO4)3 | La2(SO4)3 | ||
| Массовая доля | Температура в ° С | Массовая доля | Температура в ° С |
| 7,35 | 3,6 | 2,91 | |
| 6,96 | 15,8 | 2,53 | |
| 6,71 | 1,86 | ||
| 5,09 | 1,47 | ||
| 3,12 | 0,95 | ||
| 1,99 | 0,68 |
Таблица 7. Растворимость некоторых сульфатов лантаноидов в воде при комнатной температуре [9]
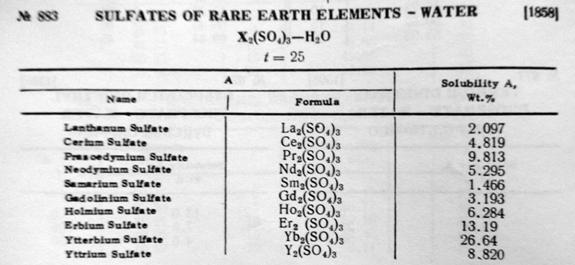
Таблица 8. Характеристики исходных растворов сульфатов калия и эрбия
| Вещество | Количество воды (мл) | Условия (температура в ° С) | Количество вещества | |
| в г | в моль | |||
| K2SO4 | 0,05747 | |||
| Er2(SO4)3 | 0,01285 |
Дальнейшие расчеты проводились относительно количества сульфата эрбия по причине его меньшей растворимости. Для получения эрбийкалиевых квасцов использована половина имеющегося раствора (4 г) сульфата эрбия.
Таблица 9. Взятые количества сульфатов калия и эрбия
| Вещество | Количество воды (мл) | Условия (температура в ° С) | Количество вещества | |
| в г | в моль | |||
| K2SO4 | 1,12 | 0,00643 | ||
| Er2(SO4)3 | 0,00643 |
1,12 г сульфата калия растворили в 11 мл воды при комнатной температуре, затем влили получившийся раствор в холодный раствор сульфата эрбия и оставили кристаллизоваться.
3. Получение иттрийкалиевых квасцов — KY(SO4)2 · 12H2O
K2SO4 + Y2(SO4)3 + 24H2O = 2KY(SO4)2 · 12H2O
Перед началом получения квасцов необходимо было получить сульфат иттрия из кристаллогидрата нитрата иттрия:
2Y(NO3)3 + 3H2SO4 = Y2(SO4)3 + 6HNO3.
В качестве источника нитрата иттрия был использован кристаллогидрат нитрата иттрия (Y(NO3)3 · 6H2O) массой 6,32 г (0,0165 моль). По уравнению реакции количество серной кислоты составило 0,02475 моль, что соответствует 1,375 мл серной кислоты концентрации 18 моль/л. Для проведения реакции кристаллогидрат нитрата иттрия растворяется в воде при нагревании, затем к раствору добавляется серная кислота. Из уравнения реакции количество полученного сульфата иттрия составляет 0,00825 моль, необходимо взять такое же количество сульфата калия. 1,44 г сульфата калия растворяется в 10 мл воды при нагревании.
После сливания растворов сульфата калия и сульфата иттрия сразу же выпал осадок. После рентгенофазового анализа выяснилось, что в осадок выпал сульфат иттрия. Раствор профильтровался и был оставлен для кристаллизации.
Рентгенофазовый анализ
Полученные в работе образцы исследовали при помощи рентгенофазового анализа (РФА), основанного на явлении дифракции рентгеновских лучей в кристалле. Съемка рентгенограмм при комнатной температуре проводилась с использованием камеры Гинье Huber G670 (CuKα1 – излучение, λ = 1.54056 Ǻ). Для проведения фазового анализа применялся программный пакет STOE WinXpow с использованием базы данных JCPDS PC-PDF2. Рентгенофазовый анализ проводился на химфаке МГУ А.В. Морозовым.
Обсуждение результатов
Железокалиевые квасцы — KFe(SO4)2 · 12H2O
Через неделю после сливания растворов сульфата калия и сульфата железа выпали кристаллы светло-желтого цвета (рис. 7).

Рис. 7. KFe(SO4)2 · 12H2O – железокалиевые квасцы
Они были отфильтрованы, высушены при комнатной температуре на воздухе и подвергнуты рентгенофазовому анализу, который подтвердил, что основным компонентом кристаллов являются железокалиевые квасцы, но имеется примесь кислого сульфата железа (рентгенограмма 1). Было решено очистить продукт перекристаллизацией (рис. 8), проведено растворение продукта с добавлением сульфата калия, раствор был оставлен для кристаллизации.
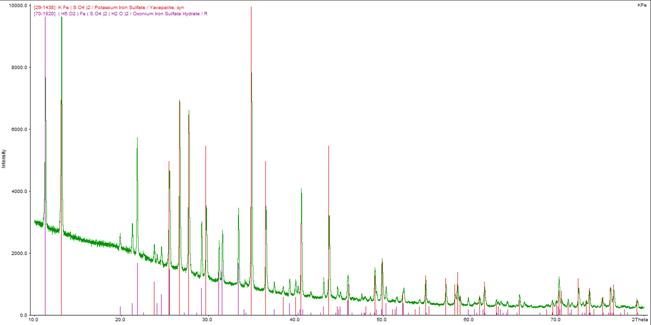
Рентгенограмма 1. KFe(SO4)2 · 12H2O – железокалиевые квасцы с примесью кислой соли железа


Рис. 8. Перекристаллизация железокалиевых квасцов KFe(SO4)2 · 12H2O
Железоцезиевые квасцы — CsFe(SO4)2 · 12H2O
В осадке, выпавшем сразу же после сливания растворов сульфата железа и сульфата цезия, после высушивания обнаружились две фракции, светло-зелёного и зелёного цвета, которые были разделены и перетёрты в ступке (рис. 9).

Рис. 9. Осадок, выпавший после сливания растворов сульфатов цезия и железа
Далее эти вещества подверглись рентгенофазовому анализу, в ходе которого было установлено, что данные вещества не являются квасцами (рентгенограммы 2 и 3). В светло-зелёной фракции был обнаружен иодат железа Fe(IO3)3.
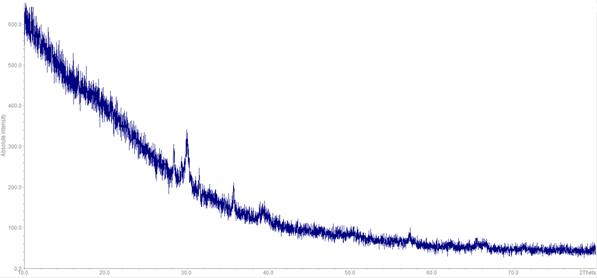
Рентгенограмма 2. Зелёная фракция осадка, выпавшего после сливания растворов сульфатов цезия и железа
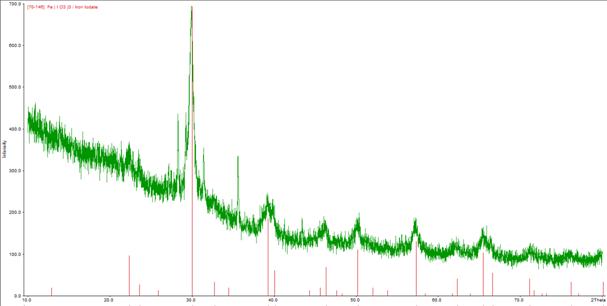
Рентгенограмма 3. Светло-зелёная фракция осадка, выпавшего после сливания растворов сульфатов цезия и железа
Также для установления качественного состава полученного осадка было проведено прокаливание (рис. 10). В процессе интенсивного нагревания исследуемого образца наблюдалось выделение фиолетового газа, идентифицированного как иод I2, который мог выделяться при разложении непрореагировавшего иодата цезия или иодата железа. Был сделан вывод, что исследуемое вещество не является квасцами.


Рис. 10. Прокаливание осадка, выпавшего после сливания растворов сульфатов цезия и железа
В растворе, оставленном для кристаллизации, через неделю выпали кристаллы, которые были отфильтрованы и просушены (рис. 11).


Рис. 11. Железоцезиевые квасцы CsFe(SO4)2 · 12H2O
Часть кристаллов была отобрана для рентгенофазового анализа (рис. 12), остальная часть подверглась перекристаллизации.

Рис. 12. Кристаллы железоцезиевых квасцов CsFe(SO4)2 · 12H2O
В результате рентгенофазового анализа (рентгенограмма 4) было установлено, что кристаллы являются чистыми железоцезиевыми квасцами с микроскопической примесью Fe(OH)3.
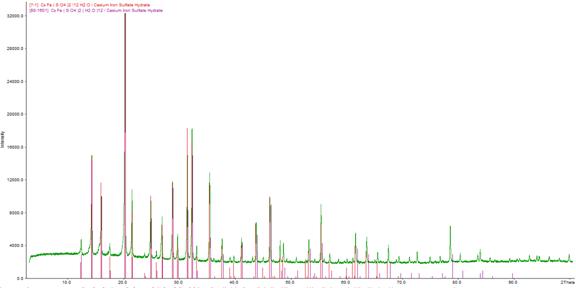
Рентгенограмма 4. CsFe(SO4)2 · 12H2O железоцезиевые квасцы
В отфильтрованный раствор была помещена затравка, в качестве которой выбрали небольшой кристалл, прикреплённый на нитку.

Рис. 13. Рост кристалла железоцезиевых квасцов CsFe(SO4)2 · 12H2O
Октаэдрическая форма кристалла подтверждает тот факт, что полученное вещество действительно является квасцами [2].
Эрбийкалиевые квасцы — KEr(SO4)2 · 12H2O
Через месяц вода из раствора полностью испарилась, и на дне колбы остался осадок розового цвета (рис. 14), который собрали и проанализировали.


Рис. 14. Предположительно эрбийкалиевые квасцы CsEr(SO4)2 · 12H2O
С помощью рентгенофазового анализа не удалось установить состав полученного вещества, так это вещество отсутствовало в базе данных.
На рентгенограмме 5 представлено сопоставление графиков исследуемого образца (зелёным цветом), предположительно KEr(SO4)2, и дигидрата KLu(SO4)2 (красным цветом).
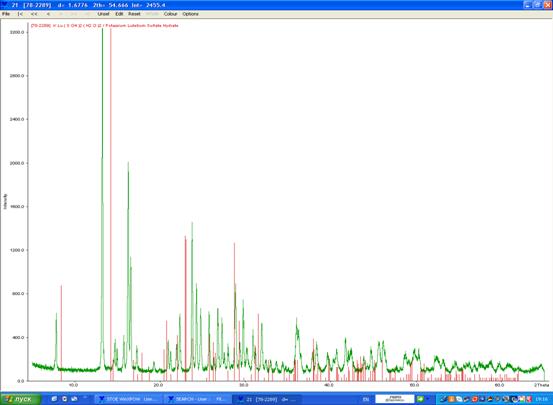
Рентгенограмма 5. Предположительно KEr(SO4)2 · 12H2O (зелёным) и KLu(SO4)2 · 2H2O (красным цветом).
На рентгенограмме 6 представлено сопоставление графиков исследуемого образца (зелёным цветом), предположительно KEr(SO4)2, и кислого сульфата церия (III) (красным).
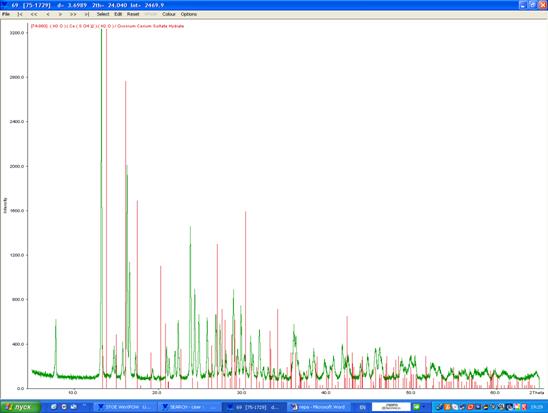
Рентгенограмма 6. Предположительно KEr(SO4)2 · 12H2O (зелёным) и кислый сульфат церия (III) (красным цветом).
Рентгенограмма проявляет некоторое сходство в расположении линий (со сдвигом, обусловленным разницей в радиусах атомов) с данными для упомянутых веществ, и возможно предположить присутствие в нашем образце аналогичных фаз KEr(SO4)2 · 2H2O и гидрата кислого сульфата эрбия. Однако однозначно утверждать это нельзя, и вопрос нуждается в дополнительном исследовании (выращивании кристалла и определении структуры).
Проводилось прокаливание этого образца (рис. 15).


Рис. 15. Прокаливание предположительно эрбийкалиевых квасцов
Исходная масса образца составляла 0,8 г, после прокаливания осталось 0,63 г, таким образом, потери по массе составили 21,25%. На основе этих данных было сделано предположение, что исследуемое вещество имеет формулу: KEr(SO4)2 · 6H2O, которая не соответствует формуле квасцов.
Прокаленное вещество было также подвергнуто рентгенофазовому анализу (рентгенограмма 7), который показал, что основная фаза похожа на K6Er4(SO4)9, есть (возможно) примесь K2S2O5. Это может говорить о том, что у нас был избыток калия по сравнению с эрбием. Если исходить из состава безводного вещества K6Er4(SO4)9, то исходному гидрату можно приписать формулу K6Er4(SO4)9 · 21Н2О.
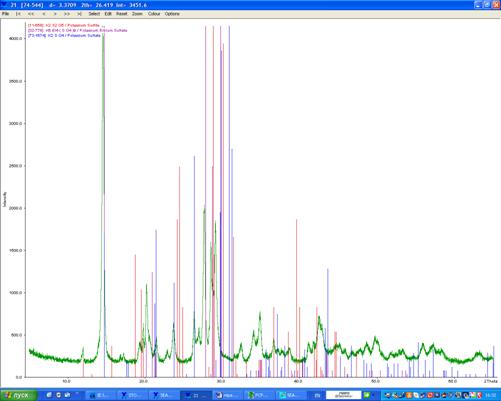
Рентгенограмма 7. Предположительно KEr(SO4)2 · 12H2O (зелёным), K6Er4(SO4)9 · 2H2O (сиреневым), K2S2O5 (красным цветом) и K2SO4 (синим)
Иттрийкалиевые квасцы — KY(SO4)2 · 12H2O
В растворе выпали кристаллы, которые были подвергнуты рентгенофазовому анализу (рентгенограмма 8), который показал, что образец похож на квасцы, но, возможно, есть примесь K6Y4(SO4)9.
Образец хорошо закристаллизован и может иметь текстуру (определенный рельеф), которая осложняет интерпретацию рентгеновских данных. Поэтому для окончательного доказательства состава образца решено вырастить монокристалл.
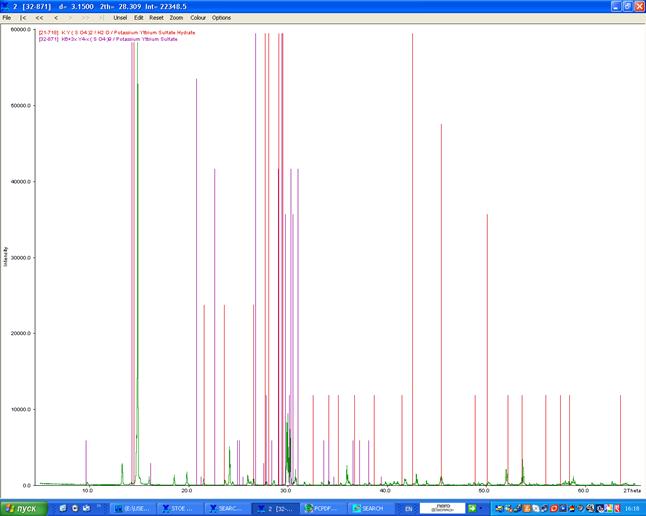
Рентгенограмма 8. KY(SO4)2 · 12H2O иттрийкалиевые квасцы
Выводы
1. Предложена и успешно опробована более простая методика получения железокалиевых квасцов по сравнению с имеющейся в литературе.
2. Предложенная методика модицифирована для получения некоторых других квасцов (железоцезиевых, иттрийкалиевых) с учетом имеющихся реагентов (не сульфатов).
3. Выращен монокристалл железоцезиевых квасцов размером 7·7 мм.
4. При попытке применить разработанную методику для получения эрбийкалиевых квасцов обнаружена неизвестная фаза, отсутствующая в рентгеновской базе данных. По различным оценкам, состав фазы может соответствовать смеси KEr(SO4)2 · 2H2O и ErH(SO4)2 · 2H2O, гидрату KEr(SO4)2 · 6H2O или K6Er4(SO4)9 · 21Н2О.
Список литературы
1. Б.В. Некрасов. 1973. Основы общей химии. Том 2. С. 520-521
2. М.П. Шаскольская. 1984. Кристаллография. С. 11-20, 56-58, 130-136
3. А.В. Шубников. 1947. Образование кристаллов. С 18-21, 32
4. Мир минералов. [Электронный ресурс]. URL: https://mineralys.ru/kak-vyirastit-kristall/#kvastci (дата обращения: 25.11.2014).
5. Большая Медицинская Энциклопедия. [Электронный ресурс]. URL: https://bigmeden.ru/article/%D0%9A%D0%B2%D0%B0%D1%81%D1%86%D1%8B (дата обращения: 27.11.2014).
6. Wikipedia: The Free Encyclopedia. [Электронный ресурс]. URL: https://en.wikipedia.org/wiki/Alum (дата обращения: 30.11.2014).
7. О. Ольгин. Опыты без взрывов. 2012. С. 22
8. Ю.Ю. Лурье. Справочник по аналитической химии. М., Химия, 1989.
9. Справочник химика. - М., Л.: 1965, т.3
10. Э.Н. Рэмсден. 1989. Начала современной химии. С. 413
11. С.А. Балезин. 1975. Основы физической и коллоидной химии. С. 289