РЕФЕРАТ
по дисциплине: «_Органическая_Химия_»
на тему:
Химические свойства непредельных углеводородовнапримере 2-метилбутен-2
Выполнила:
студентка _2__ курса,
группы __ЭРП-1407____
Воронина_Марина_Олеговна
Проверила:
Доцент кафедры ТПМ
Лагусева_Елена_Ивановна
Содержание
1. Введение………………………………………………………….…3.с.
2. Физические свойства………………………………………….……5.с.
3. Применение………………………………………………………....6.с.
4. Химические свойства………………………………………………7.с.
5. Получение……………………………………………………..……10.с.
6. Заключение………………………………………………………….12.с.
7. Список литературы…………………………………………………13.с.
Введение
Прежде чем разбираться в непредельных углеводородах, надо выяснить что такое Органические вещества — класс химических соединений, в состав которых входит углерод (за исключением оксидов Углерода, карбидов, угольной кислоты, карбонатов и цианидов). Основные классы органических соединений биологического происхождения — белки, липиды, углеводы, нуклеиновые кислоты — содержат, помимо углерода, преимущественно водород, азот, кислород, серу и фосфор. Именно поэтому «классические» органические соединения содержат прежде всего водород, кислород, азот и серу — несмотря на то, что элементами, составляющими органические соединения, помимо углерода могут быть практически любые элементы.
Соединения углерода с другими элементами составляют особый класс органических соединений — элементоорганические соединения. Металлоорганические соединения содержат связь металл-углерод и составляют обширный подкласс элементоорганических соединений. Теперь рассмотрим Углеводоро́ды — органические соединения, состоящие исключительно из атомов углерода и водорода. Углеводороды считаются базовыми соединениями органической химии, все остальные органические соединения рассматривают как их производные.
Поскольку углерод имеет четыре валентных электрона, а водород — один, простейший углеводород — метан (CH4). И вот теперь мы сможем себе представить что такое непредельныеуглеводороды-непредельными или ненасыщенными называются углеводороды, содержащие в составе молекулы одну или несколько кратных (двойных или тройных) связей. 2-метилбутен-2являетьсяалкеном – это непредельные углеводороды, молекула которых содержит одну двойную связь. Поскольку первым представителем гомологического ряда алкенов является этилен СН2=СН2, эти вещества называют также углеводородами ряда этилена (этиленовыми углеводородами). Часто применяют и еще одно название алкенов – олефины*.Молекулы алкенов содержат на два атома водорода меньше, чем молекулы алканов с тем же числом атомов углерода. Общая формула алкенов–CnH2n
Физические свойства алкенов
Физические свойства алкенов и алканов схожи. Первые четыре члена гомологического ряда этилена - газы, далее до С16Н32 - жидкости, а высшие алкены являются твердыми веществами. Температуры кипения и плавления с удлинением углеродной цепи возрастают. Плотность большинства жидких алкенов лежит в пределах 0,6 ‑ 0,7 г/мл
Для алкенов характерны реакции присоединения по двойной связи, при этом. одна из двойных связей между атомами углерода разрывается и к атомам углерода присоединяются другие атомы и группы, образуя насыщенные углеводороды.Помимо изомерии, связанной со строением углеродной цепи, в ряду олефинов наблюдается изомерия положения двойной связи. Кроме того, у олефинов имеет место пространственная (геометрическая) или цис-транс-изомерия.Метильные группы могут располагаться как по одну сторону двойной связи (такой изомер называется цис-изомером), так и по разные стороны (такой изомер называется транс-изомером). Названия упомянутых изомеров происходят от латинского cis - на этой стороне и trans- через, на другой стороне. Превращение изомеров друг в друга невозможно без разрыва двойной связи. Реакции присоединения идут намного легче, чем реакции замещения.
Таблица 1 Физические свойства некоторых алкенов 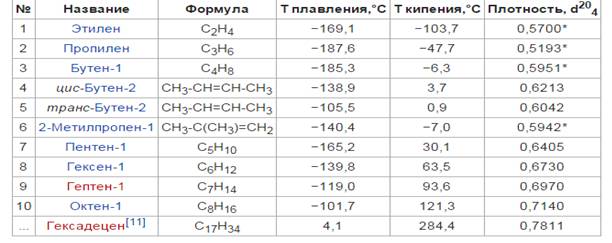
Примениение
Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов. Широкое применение в промышленности органического синтеза углеводородов, содержащихся в газообразных и жидких продуктах переработки нефти, требует все более и более детального исследования этих продуктов. Индивидуальные углеводороды, содержащиеся в газах, получающихся в процессах переработки нефти, в бензинах и прямой гонки и бензинах вторичного происхождения являются прекрасным сырьем для нефтехимического синтева. Определение углеводородного состава сложных продуктов даже с применением такого эффективного метода,каким является газо-жидкостная хроматография, является достаточно сложной проблемой. Особенно большое значение имеет определение таких компонентов, как изопрен, цис- и 7иракс-пиперилены, 2-метилбутен-2 и др.
2-метилбутен-2 № ООН 2460 (UN2460)
2-метилбутен-2 (СH3)2=СНСH3 - tпл -133,8°C, tкип 38,6°C; d420 0,662; не растворяется в воде, растворяется в этаноле, углеводородах; tвсп -28,9°C; концентрационные пределы воспламенения 1,4-8,7%; применяется для синтеза изопрена; раздражает дыхательные пути, слизистые оболочки; обладает наркотическим действием (ПДК 50 г/м3).
Химические свойства алкенов
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность  -связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения. Упрощенно схему реакции присоединения можно представить следующим образом:
-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения. Упрощенно схему реакции присоединения можно представить следующим образом:
4.1 Реакции присоединения
4.1.1 Галогенирование. Алкены обесцвечивают бромную воду:
Эта реакция является качественной на непредельные углеводороды. По правилу Марковникова
4.1.2 Гидрогалогенирование (присоединение галогеноводородов):
К гомологам этилена галогеноводороды присоединяются в соответствии с правилом Марковникова: атом водорода присоединяется к наиболее гидрированному атому углерода, а атом галогена – к наименее гидрированному:
4.1.3 Гидратация. Взаимодействие алкенов с водой происходит в присутствии минеральных кислот (Н2SO4, H3PO4), выполняющих роль катализаторов. Присоединение воды идет также по правилу Марковникова:
Данная реакция в присутствии твердых катализаторов используется для получения этилового спирта из непредельных углеводородов, содержащихся в продуктах крекинга нефти, попутных газах, коксовых газах.
4.1.4 Изомеризация алкенов и их производных в присутствии кислот протекает по механизму электрофильного присоединения.
4.2 Реакции окисления
4.2.1При мягком окислении алкенов водным раствором КМnO4 (реакция Вагнера) образуются двухатомные спирты.
В результате протекания этой реакции фиолетовый раствор перманганата калия обесцвечивается и выпадает коричневый осадок MnO2. Это также качественная реакция на двойную связь.
4.2.2При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2:
4.2.3 На серебряном катализаторе при 200 ºС алкены с кислородом образуют оксиды алкена.
4.2.4 Горение. Как и все углеводороды, алкены горят с образованием СО2 и Н2О:
Получение алкенов
Алкены в небольших количествах встречаются в нефтях некоторых месторождений.Посколькуалкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
В промышленности алкены получают:
5.1 Дегидрированием алканов:
5.2В лаборатории алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов и образуется дополнительная π – связь.
5.2.1 Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами (Н2SO4 или Н3РО4) при температуре выше 150 0С.
5.2.2 Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на галогеналканы:
При отщеплении Н2О от спиртов, НBr и НСl от галогеналканов атом водорода преимущественно отщепляется от наименее гидрированного атома углерода. Эта закономерность носит название правила Зайцева.
5.2.3 дегалогенированиедигалогенидов осуществляют при нагревании с активными металлами:
Заключение
Приблизительно 90% всей добываемой нефти используют в качестве топлива. Несмотря на то, что та часть нефти, которая используется для получения нефтехимических продуктов, мала, эти продукты имеют очень большое значение. Из продуктов перегонки нефти получают много тысяч органических соединений. Они в свою очередь используются для получения тысяч продуктов, которые удовлетворяют не только насущные потребности современного общества, но и потребности в комфорте
Рисунок 1 Применения продуктов нефтехимической промышленности.

Хотя различные группы химических продуктов, указанные на рис. 6, в широком смысле обозначены как нефтехимические продукты, поскольку их получают из нефти, следует отметить, что многие органические продукты, в особенности ароматические соединения, в промышленности получают из каменноугольной смолы и других источников сырья. И все же приблизительно 90% всего сырья для органической промышленности получают из нефти.
Ниже будут рассмотрены некоторые типичные примеры, показывающие использование углеводородов в качестве сырья для химической промышленности.
Список литературы
1. Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т / В.Ф.Травень. — М.: ИКЦ «Академкнига», 2004. — Т. 1. — 727 с. — ISBN 5-94628-171-2.
2. Фигуровский Н.А. История химии: Учеб.пособие для студентов пед. ин-тов по хим. и биол. спец. — М.: Просвещение, 1979. — С. 102.
3. Соловьев Ю. И. История химии: Развитие химии с древнейших времен до конца XIX в. Пособие для учителей. — 2-е изд., перераб. — М.: Просвещение, 1983. — С. 208.