Металл, выбранный по варианту из табл. 6.2, очистите наждачной бумагой, промойте водой, протравите в течение 1-2 мин в разбавленной HNO3 (2-3 мл кислоты налейте в пробирку и опустите в нее металлический пруток), ополосните дистиллированной водой, высушите фильтровальной бумагой.
Т а б л и ц а 6.2
Задание к опыту 6.2.2
| Вариант | |||||||
| Металл | Zn | Cu | Fe | Ni | Ti | Pb | Sn |
| Раствор | ZnSO4 | CuSO4 | Fe2(SO4)3 | NiSO4 | Ti(SO4)2 | Pb(NO3)2 | Sn(NO3)2 |
Налейте в сосуд 1 (рис. 6.2) раствор соли нужной концентрации (начиная с самой меньшей концентрации).
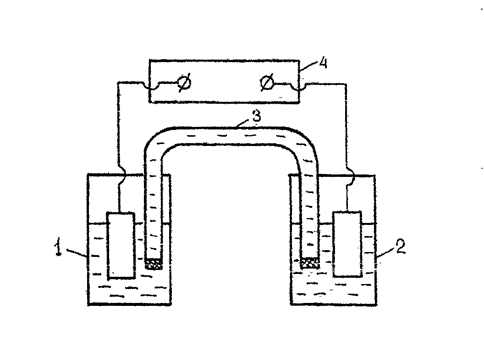
Рис. 6.2. Схема установки для измерения электродного потенциала металлов:
1 – ячейка с исследуемой системой; 2 – электрод сравнения; 3 – электролитический ключ
с насыщенным раствором KCl; 4 – электронный вольтметр
Опустите металл в сосуд. Составьте гальванический элемент: исследуемый электрод и электрод сравнения (медно-сульфатный электрод). Зачищенные концы проводов гальванического элемента подключите к соответствующим клеммам электронного вольтметра В722А, или осциллографа-мультимера типа С1-112, или другого аналогичного прибора с входным сопротивлением не менее 10 МОм и определите ЭДС.
По измеренному значению и уравнению (6.11) найдите экспериментальное значение электродного потенциала в данном электролите (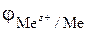 ).
).
Удалите металлический электрод, положите на фильтровальную бумагу, вылейте раствор с малой концентрацией 0,001 М и налейте раствор с концентрацией 0,01 М, опустите электрод и вновь измерьте ЭДС; проделайте то же и при концентрации соли 0,1 М, 1 М, 2 М.
Пересчитайте измеренные величины потенциалов на водо-родную шкалу, аналогично следующим примерам и табл. 6.3.
1. Пересчет потенциалов алюминиевого и других электродов, измеренных по хлорсеребряному электроду сравнения

 = 0,202 В.
= 0,202 В.
2. Пересчет потенциалов медного электрода, измеренных по алюминиевому электроду сравнения

3. Пересчет потенциалов цинкового электрода, измеренных по алюминиевому электроду сравнения

Опытные значения потенциалов сопоставьте с рассчитанными по уравнению Нернста.
Постройте график зависимости расчетных и опытных значений потенциала металла 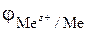 от концентрации соли металла (ордината –
от концентрации соли металла (ордината – 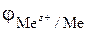 , абсцисса –
, абсцисса – 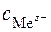 ).
).
Т а б л и ц а 6.3
Примеры пересчета потенциалов на водородную шкалу
| № | Исследуемый электрод | Электрод сравнения | Измеренная ЭДС | Расчет |
| Al3+/Al | Ag/AgCl/H+ | –0,738 | 0,202–0,738= –0,536 B | |
| Zn2+/Zn | Ag/AgCl/H+ | –0,980 | 0,202–0,980= –0,778 | |
| Cu2+/Cu | Ag/AgCl/H+ | –0,039 | 0,202–0,039= –0,163 B | |
| Zn2+/Zn | Al3+/Al | 0,241 | –0,536–0,241= –0,778 B | |
| Cu2+/Cu | Al3+/Al | –0,699 | –0,536+0,699= 0,163 B |
Опыт 6.2.3. Определение ЭДС гальванического элемента
Гальванические элементы соберите из двух металлических электродов, помещенных в два колена сосуда и соединенных электролитическим ключом. Согласно табл. 6.4 по варианту возьмите два металла, из склянок – растворы солей данных металлов с указанными значениями концентраций (молярных концентраций). Заполните на 2/3 каждое колено соответствующим раствором. Наждачной бумагой зачистите металлы, промойте водой, просушите фильтровальной бумагой, опустите в колена электролизера, подсоедините провода от данных металлов к клеммам измерительной системы (электронный вольтметр, потенциометр). Измерьте ЭДС. Сравните измеренную ЭДС с теоретической величиной ЭДС.
Т а б л и ц а 6.4
Задание к опыту 6.2.3
| Вариант | |||
| Металлы | Zn Pb | Zn Sn | Fe Sn |
| Растворы солей | ZnSO4 PbSO4 0,1 M 0,1 M | ZnSO4 SnSO4 0,1 M 0,1 M | Fe2(SO4)3 SnSO4 0,1 M 0,1 M |
| Вариант | |||
| Металлы | Fe Pb | Al Pb | Al Sn |
| Растворы солей | Fe2(SO4)3 PbSO4 0,1 M 0,1 M | AlCl3 Pb(NO3)2 0,1 M 0,1 M | AlCl3 Sn(NO3)2 0,1 M 0,1 M |
Опыт 6.2.4. Измерение напряжения гальванического
Элемента
Подключите провода от электродов к вольтметру, измерьте ЭДС. Разомкните ключ. С помощью вольтметра определите напряже-ние элемента с разомкнутой внешней цепью. Ключом замкните внешнюю цепь. Постепенно повышайте плотность тока до тех пор, пока напряжение элемента не приблизится к нулю. Снимите 4-5 показаний в течение 15 мин. По данным значениям плотности тока и напряжения постройте вольтамперную кривую (абсцисса – плотность тока, ордината – напряжение). Объясните, почему напряжение элемента не равно ЭДС и уменьшается с повышением плотности тока.
Опыт 6.2.5. Концентрационный гальванический элемент
Если концентрации растворов солей металла отличны, но сами электроды состоят из одного и того же металла, то при изучении таких электродов, опущенных в растворы одинаковой соли, но разной концентрации и соединенных электролитическим ключом, возникает ЭДС.
ЭДС концентрационного элемента составляет:
 (6.22)
(6.22)
где с 1 > с 2; с 1, с 2 – концентрации солей.
В два колена электролизера налейте растворы, в первое колено с концентрацией с 1, во второе – с 2. Зачистите 2 прутка одинакового металла, согласно табл. 6.5, промойте дистиллированной водой, высушите фильтровальной бумагой, опустите в оба колена. Провода от электродов подсоедините к клеммам измерительного прибора. Рассчитайте теоретическую ЭДС и сравните ее с измеренной величиной.
Т а б л и ц а 6.5
Задание к опыту 6.2.5
| Вариант | ||||
| Металл | Zn Zn | Zn Zn | Zn Zn | Zn Zn |
| Растворы солей | ZnSO4 ZnSO4 2M 0,001 M | ZnSO4 ZnSO4 2M 0,01 M | ZnSO4 ZnSO4 2 M 0,1 M | ZnSO4 ZnSO4 2 M 1 M |
| Вариант | ||||
| Металл | Cu Cu | Cu Cu | Cu Cu | Cu Cu |
| Растворы солей | CuSO4 CuSO4 2 M 0,001 M | CuSO4 CuSO4 2 M 0,01 M | CuSO4 CuSO4 2M 0,1 M | CuSO4 CuSO4 2 M 1 M |
Опыт 6.2.6. Определение напряжения разложения
При пропускании тока через раствор, например, щелочи с двумя инертными электродами, анод ведет себя как кислородный, а катод – как водородный электрод. При малом напряжении источника тока на электродах электрохимической реакции нет, но число электронов на катоде увеличивается, на аноде – уменьшается. Двойные электри-ческие слои изменяются, и возникает обратимая ЭДС поляризации. Ток при этом мал, его называют остаточным. Когда же внешнее напряжение увеличится до значения Е разлож. (напряжение разложе-ния), то начинаются электрохимические процессы на обоих электро-дах и через ячейку протекает ток.
Для экспериментального определения Е разлож. ведут электролиз со ступенчатым повышением напряжения, измеряя при этом ток. Например, устанавливают напряжение 0,2 В и измеряют ток, затем выставляют 0,25 В и также измеряют ток, так до значения напряжения 2-2,5 В. По полученным данным строится зависимость «ток – напряжение» и определяется значение Е разлож. из графика (рис. 6.3).
 |
Рис.6.3. Схема определения напряжения разложения по I-U кривой
Рис. 6.3. Схема определения напряжения разложения по I – U кривой
Определите Е разлож. для раствора, приведенного в табл.6.6, напишите уравнения реакций на электродах, рассчитайте 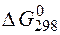 ,
,  и сравните последнее с полученным значением Е разлож..
и сравните последнее с полученным значением Е разлож..
Т а б л и ц а 6.6
| Вариант | ||||||
| Раствор, 1 М | H2SO4 | HNO3 | H3PO4 | NaOH | KOH | NH4OH |
| Вариант | ||||||
| Раствор, 1 М | Na2SO4 | ZnSO4 | AgNO3 | HCl | H2SO4 | H3PO4 |
Опыт 6.2.7. Закон Фарадея
Экспериментальная установка (рис. 6.4) включает электролизер (1), амперметр (4), реостат (5) и источник постоянного тока (6).

Рис. 6.4. Схема установки для электролиза воды:
1 – электролизер; 2 – анод; 3 – катод; 4 – амперметр; 5 – реостат; 6 – выпрямитель
Электролизер (1) служит для электролитического разложения воды и сбора продуктов электролиза – водорода над катодом (3)
и кислорода – над анодом (2).
В качестве выпрямителя 6 рекомендуются стабилизированные источники питания типа Б5-44А, тогда амперметр 4 и реостат 5 из схемы можно исключить. Методика измерений в этом случае следующая.
1. Установить переключатель в положение «ток», напряжение на «max», ток на «min».
2. Подключить ячейку к клеммам (–) и (+).
3. Включить выпрямитель в сеть, установить требуемый ток, например, 100 мА. В случае, если справа постоянно или периоди-чески включается лампочка – необходимо регулировать напряжение.
4. Ток может меняться в процессе электролиза из-за процессов в ячейке, поэтому надо постоянно наблюдать за установкой.
5. Для измерения тока надо найти значение, при котором происходит переключение.
Эксперимент выполняется следующим образом:
а) обе трубки электролизера заполните электролитом до нулевой отметки, пользуясь уравнительной склянкой 2, плотно закройте краны;
б) установите заданный ток с помощью реостата, согласно табл. 6.7 (0,1-0,7 А), и после выделения водорода до отметки 30 мл выключите;
в) запишите значения тока I в амперах и времени электролиза t в секундах; совместите уровни выделившихся газов и уравнительной склянки 2, запишите значения отметок по шкалам; вернув уравнительную склянку на место, измерьте линейкой высоты столбов жидкости между уровнями, соответственно, водорода и жидкости в уравнительной склянке (h 1), и то же для кислорода (h 2) в сантиметрах.
Под действием выделяющихся газов (на катоде – водорода и на аноде – кислорода) наблюдается постепенное вытеснение раствора щелочи газами. Измерьте по разности объемов (V 2 – V 1), где V 1 – первоначальный объем и V 2 – объем выделившегося газа после электролиза.
Т а б л и ц а 6.7
Задание к опыту 6.2.7
| Вариант | ||||||||||||
| I, A | 0,10 | 0,15 | 0,20 | 0,25 | 0,30 | 0,35 | 0,40 | 0,45 | 0,50 | 0,55 | 0,60 | 0,65 |
| t, мин | ||||||||||||
| Расчет по О2 или Н2 | Н2 | Н2 | Н2 | О2 | О2 | О2 | Н2 | Н2 | Н2 | О2 | О2 | О2 |
| Параметр | 
| F | Na | 
| F | Na | 
| F | Na | 
| F | Na |
Для расчетов необходимо объем выделившегося газа V газ при данной температуре (273 + t 0С) и давлении привести к нормальным условиям и рассчитать V 0 по формуле Менделеева – Клайперона:
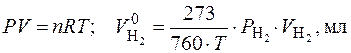 . (6.23)
. (6.23)
Парциальное давление водорода  рассчитайте по формуле
рассчитайте по формуле
 , мм. рт. ст, (6.24)
, мм. рт. ст, (6.24)
где Р бар – давление в аудитории (показатель барометра), мм. рт. ст; Р ж – парциальное давление жидкости, значение которого определяется по формуле
Р ж = h 1. d ж/13,6, мм. рт. ст, (6.25)
где d ж – плотность раствора (для 20 %-й щелочи равна 1,22 г/см3).
Парциальное давление насыщенных паров воды над раствором щелочи определяется по табл. 6.8.
Т а б л и ц а 6.8
Парциальное давление насыщенных паров воды
над раствором щелочи
| с (NaOH), масс. % | T 0C | Парциальное давление, мм. рт. ст. |
| 10,8 14,9 20,2 | ||
| 9,6 13,2 17,8 | ||
| 8,0 10,9 14,9 |
В зависимости от задания необходимо рассчитать заряд электрона ( ), число Фарадея (F), число Авогадро (N), выход по току по водороду (
), число Фарадея (F), число Авогадро (N), выход по току по водороду ( ) или по кислороду (
) или по кислороду ( ). Во всех случаях расчет количества электричества производится по формуле
). Во всех случаях расчет количества электричества производится по формуле
Q = I · τ, A·с.
Опыт 6.2.7.1. Определение выхода по току по водороду ( )
)
и по кислороду ( )
)
Выход по току η = 
или
η =  ·100 %.
·100 %.
При определении выхода по току по водороду по закону Фарадея
 , где Э =
, где Э =  ,
,
используем формулы
 , (6.26)
, (6.26)
 . (6.27)
. (6.27)
Опыт 6.2.7.2. Расчет заряда электрона
Число выделившихся на катоде молекул водорода  , на аноде молекул кислорода
, на аноде молекул кислорода  определяется по закону Авогадро по формулам
определяется по закону Авогадро по формулам
 ; (6.28)
; (6.28)
 , (6.29)
, (6.29)
где 6,02. 1023 – число Авогадро, количество молекул в 1 моле;
 – объем 1 моля газа – 22400 мл.
– объем 1 моля газа – 22400 мл.
Отсюда заряд электрона определяется по уравнениям
 =
=  ;
;  =
=  . (6.30)
. (6.30)
Опыт 6.2.7.3. Определение постоянной Фарадея (F)
Согласно закону Фарадея на выделение 1 моля водорода расходуется по реакции (6.18) 2 F Кл электричества, а на  молей водорода – измеренное количество электричества Q.
молей водорода – измеренное количество электричества Q.
Количество молей выделившегося на катоде водорода  вычисляем по формуле
вычисляем по формуле
 . (6.31)
. (6.31)
Число Фарадея определяется по формуле
 , Кл. моль-1, (6.32)
, Кл. моль-1, (6.32)
где  – выход по току водорода в долях единицы.
– выход по току водорода в долях единицы.
Опыт 6.2.7.4. Определение числа Авогадро (N)
Известно, что F = N .  , отсюда
, отсюда
 , (6.33)
, (6.33)
где  – заряд электрона, табличное значение которого приведено
– заряд электрона, табличное значение которого приведено
в табл. П 1.1.
Для опытов 6.2.7.2–6.2.7.4 сопоставьте полученные опытным путем значения заряда электрона, число Фарадея, число Авогадро
с табличными значениями и найдите процент ошибки эксперимента.
Опыт 6.2.8. Электролитическое осаждение металла
Электролиз растворов солей металлов широко используется в технологии машиностроения в двух направлениях: катодный процесс – с целью нанесения гальванических покрытий, анодный – электролитического полирования, фрезерования, сверления и другой обработки твердых сплавов. В металлургии с помощью электролиза водных растворов получают и рафинируют цинк, медь, никель
и другие металлы.
Для электролитического извлечения цинка используется установка (рис.6.5), которая включает электролизную ванну (1), амперметр (2), вольтметр (3), реостат (4) и соединительный ключ (5). В качестве источника постоянного тока 6 предпочтительнее использовать стабилизированный источник питания типа Б5-46. В этом случае схема (рис. 6.5) упрощается – можно исключить ее элементы 2-5.

Рис.6.5. Схема установки для электролиза растворов:
1 – электролизер; 2 – амперметр; 3 – вольтметр;
4 – реостат; 5 – ключ; 6 – источник постоянного тока
Последовательность измерений в этом случае следующая:
1. Подключить ячейку;
2. Слева набрать «max» напряжение, справа – ток = 0;
3. Включить в сеть и тумблер;
4. Установить справа заданный ток. В случае, если лампочки справа указывают «ток» – все верно. Если нет, то режимы не обеспечиваются и надо регулировать напряжение или, если это не помогает, зачистить в ячейке пассивные участки на Pb, Al, Cu и др. металлах;
5. Для измерения тока при данном напряжении надо отметить его величину по регулятору справа при переключении двух лампочек справа.
Состав электролита: ZnSO4 0,5 M; H2SO4 0,2 M. Температура 20-25 0С. Силу тока и продолжительность электролиза выберите по табл.6.9 по указанию преподавателя.
Т а б л и ц а 6.9
Задание к опыту 6.2.8
| Вариант | ||||
| I, А | 0,15 | 0,2 | 0,25 | 0,3 |
| t, мин |
По значению I и суммарной площади поверхности обеих сторон алюминиевого катода рассчитайте плотность тока осаждения цинка.
Очищенный наждачной бумагой, обезжиренный в растворе 0,5 М NaOH (1-2 с), промытый водой (сначала водопроводной, затем дистиллированной) и просушенный фильтровальной бумагой алюминиевый катод (3х4 см2) высушите и взвесьте. Осмотрите свин-цовый анод. Покрытые слоем PbO2 бурого цвета аноды должны быть цельными и плотными. Электроды прикрепите к клеммам на крышке электролизера, следя за тем, чтобы катод и анод висели параллельно.
Проведите электролиз в заданном режиме (табл. 6.9), затем промойте, высушите и взвесьте катод с покрытием. Определите массу осадка (m): m = m 2 – m 1, где m 1 – масса катода до электролиза, m 2 – после электролиза. Рассчитайте массу покрытия по закону Фарадея (6.12), найдите выход по току цинка (6.13).
Опыт 6.2.9. Электрохимическая обработка металла
Под электрохимической обработкой имеют в виду изготовление отверстий или углублений заданной формы в металле путем его анодной поляризации. Подлежащая обработке заготовка служит анодом. Катод подбирается из стойкого в данном электролите материала – стали, графита, свинца и т.п. Сторона катода, обращен-ная к аноду, должна иметь форму, соответствующую контуру, который необходимо получить в результате электрохимической обработки. Поэтому катод обычно называют катодом-инструментом.
При электрохимической обработке в результате электролиза водного раствора хлористого натрия на катоде выделяется водород:
2Н2О + 2  = Н2 + 2ОН- , (6.34)
= Н2 + 2ОН- , (6.34)
а металлический анод, например, железо, окисляется:
Fe – 2  = Fe2+; (6.35)
= Fe2+; (6.35)
Fe2+ + 2 OH- = Fe(OH)2 . (6.36)
По данным табл.П 1.7 вычислите 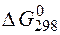 и обоснуйте целесо-образность использования электролиза для реализации реакции. Зная D G 0, найдите стандартную ЭДС окислительно-восстановительного процесса.
и обоснуйте целесо-образность использования электролиза для реализации реакции. Зная D G 0, найдите стандартную ЭДС окислительно-восстановительного процесса.
Составьте уравнения всех возможных процессов на аноде и на катоде в процессе анодной обработки железа в водном растворе хлорида натрия. Выпишите стандартные потенциалы (табл. П 1.16) и по ним оцените, какие процессы более вероятны.
Для обеспечения высокой скорости электрохимическую обработку ведут при больших плотностях тока порядка десятков и сотен А /см2. Для этого необходимо обеспечить низкое сопротивление электролита между электродами и поддерживать высокое напряжение на ванне. Для снижения сопротивления электролита в ванне между катодом-инструментом и обрабатываемой заготовкой – анодом остав-ляют по возможности минимальное расстояние, равное долям мм.
Электрохимическую обработку проводят в условиях непрерывного протока электролита через ванну, что обеспечивает постоянное удаление из межэлектродного пространства шлама, газообразного водорода, благоприятствует снижению перенапря-жений на электродах и т.п.
Электрическая схема установки для анодной обработки металлов представлена на рис.6.6.
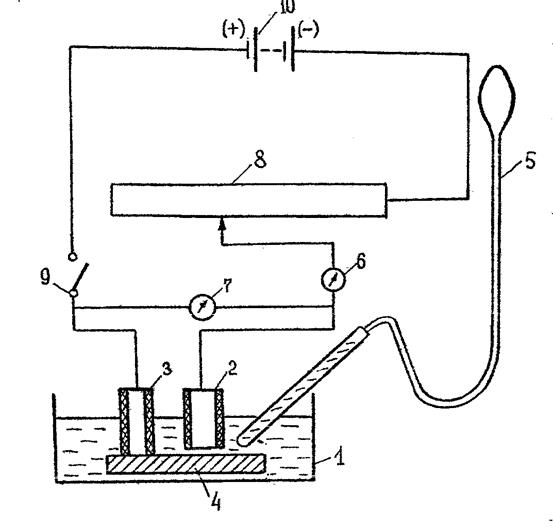
Рис.6.6. Схема установки для анодной обработки металла:
1 – электролитическая ванна; 2 – катод-инструмент;
3 – анодный токоподвод; 4 – обрабатываемая деталь;
5 – груша для подачи электролита; 6 – амперметр; 7 – вольтметр;
8 – реостат; 9 – соединительный ключ;
10 – источник постоянного тока
Установка включает электролизер (1) с катодом-инструментом (2) и токоподводом к аноду (3). Боковые поверхности токоподвода
и катода должны быть покрыты изоляционным материалом – хлорвинилом, полиэтиленом. Как показано на схеме, в цепь вклю-чается последовательно амперметр (6) и параллельно вольтметр (7).
Заготовку из стальной пластины (1х20х80 мм3) очистите наждачной бумагой, промойте водопроводной водой, просушите и окуните в расплавленный парафин. Охлажденную пластину поместите на дно электролизной ванны так, чтобы участок, где должно быть отверстие, оказался под катодом. Легким нажатием на электроды нанесите на заготовку отпечатки токоподвода и катода. Затем, вынув заготовку из ванны, осторожно зачистите скальпелем эти участки, снова вставьте заготовку в ванну и плотно прижмите к пластине токоподвод. Расстояние между катодом и обрабатываемой деталью устанавливается так, чтобы в зазор проходил лист бумаги.
После проверки преподавателем электрической схемы залейте в ванну электролит, включите ток. В момент замыкания ключа (9), осторожно передвигая ползунок реостата, выставьте напряжение около 10–12 В.
Запишите показания вольтметра и амперметра. Отметьте время начала процесса.
С помощью резиновой груши (5) набирайте и направляйте струю электролита между катодом-инструментом и обрабатываемой заготовкой. Продолжайте через каждые 2-3 мин. наблюдения и произ-ведите запись показаний приборов.
Процесс проводят до резкого увеличения силы тока в цепи, что вызывается образованием сквозного отверстия в заготовке и повышением электропроводности между электродами. Запишите время окончания электрохимической обработки.
Выключите ток, установите ползунок реостата в исходное положение. Слейте отработанный электролит из ванны и груши
в специальную емкость.
Деталь тщательно промойте водой и просушите фильтровальной бумагой. С помощью лупы или под микроскопом опишите качество поверхности и форму отверстия. По размерам отверстия рассчитайте объем растворенного металла и вычислите его массу (m практ.). Плотность металла выпишите из табл. П 1.20.
По средней величине силы тока в цепи и продолжительности электролиза, зная электрохимический эквивалент металла (табл.
П 1.20), по формуле (6.12) легко рассчитать теоретическую массу растворенного металла (m теор.).
Пользуясь уравнением (6.13), вычислите выход по току процесса анодной обработки.
Результаты опытов сведите в табл. 6.10.
Т а б л и ц а 6.10
| Вариант | ||||||||||||
| Обрабатывае- мый металл | Cu | Al | Fe | Cu | Al | Fe | Cu | Al | Fe | Cu | Al | Fe |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте определение окислительно-восстановительным реакциям.
2. Приведите примеры важнейших окислителей и восстано-вителей.
3. Как определить направление окислительно-восстанови-тельной реакции? Приведите примеры: а) в растворе; б) в гальвани-ческом элементе.
4. Какое равновесие характеризует электродный потенциал?
5. Пользуясь уравнением В. Нернста, напишите выражение для потенциала электродов (табл. П.1.16): а) Mn/Mn(OH)2;
б) MnO2/MnO  ; в) SO
; в) SO  , OH-/SO
, OH-/SO  ; г) S2O
; г) S2O  , OH-/SO
, OH-/SO  ;
;
д) Cl2(р)/ClO  .
.
6. Какие вы знаете электроды сравнения?
7. Как измеряют потенциал электрода?
8. Сформулируйте закон Фарадея. Что такое выход по току?
Какие реакции протекают при электролизе? Примеры: а) раствор NiSO4; б) CuCl2; в) NaCl; г) H2SO4.
9. Что такое напряжение разложения? Что характеризуют поля-ризационные кривые?
10. В какой последовательности происходят восстановление на катоде, окисление анионов на аноде?
11. Как рассчитываются электродные потенциалы газовых электродов с учетом парциальных давлений водорода, или кислорода и перенапряжений выделения на металлах?