СОЛИ
Соли – это электролиты, в результате диссоциации их водных растворов образуются катионы металлов и анионы кислотных остатков.
Классификация солей
Соли бывают:
1. Средние
2. Кислые
3. Основные
4. Двойные
5. Смешанные
6. Комплексные
Средние соли
В состав солей входят катионы металлов 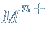 и кислотные остатки. Если кислотный остаток не содержит водорода, соли называют средними
и кислотные остатки. Если кислотный остаток не содержит водорода, соли называют средними
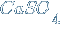 – сульфат кальция
– сульфат кальция
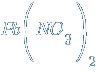 – нитрат свинца(II)
– нитрат свинца(II)
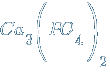 – ортофосфат кальция
– ортофосфат кальция
 – карбонат меди(II)
– карбонат меди(II)
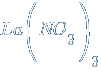 – нитрат лантана(III)
– нитрат лантана(III)
Средние соли – продукты полной нейтрализации кислот основаниями:
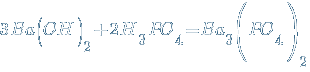 ↓
↓ 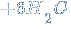 .
.
Кислые соли – продукты неполной нейтрализации:
Соли, содержащие кислотные остатки с незамещенными атомами водорода, называются кислыми, например:
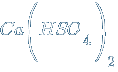 – гидросульф т кальция
– гидросульф т кальция
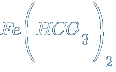 – гидрокарбонат железа(II)
– гидрокарбонат железа(II)
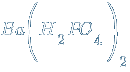 – дигидроортофосфат бария
– дигидроортофосфат бария
 – гидроортофосфат бария
– гидроортофосфат бария
Основные соли.
Соли, содержащие в своем составе гидроксогруппы, называются оснóвными, например:
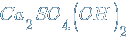 – дигидроксид-сульфат кальция
– дигидроксид-сульфат кальция
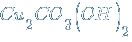 – дигидроксид-карбонат димеди
– дигидроксид-карбонат димеди
Оснóвные соли – продукты неполной нейтрализации:
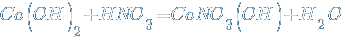
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида
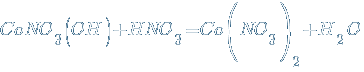
Двойные и смешанные соли
Известны также соли, содержащие два химически разных катиона – двойные соли или аниона – смешанные соли. Примеры:
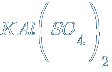 – сульфат алюминия-калия
– сульфат алюминия-калия
 – сульфат диаммония-железа(II)
– сульфат диаммония-железа(II)
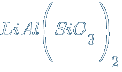 – метасиликат алюминия-лития
– метасиликат алюминия-лития
 – хлорид-гипохлорит кальция
– хлорид-гипохлорит кальция
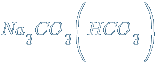 – гидрокарбонат-карбонат натрия
– гидрокарбонат-карбонат натрия
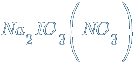 – нитрат-иодат натрия
– нитрат-иодат натрия
Часто двойные и смешанные соли малорастворимы в воде. Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
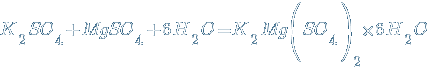
Соли в природе
|
|
Очень многие соли, используемые химиками, встречаются в природе.
Природные соли можно классифицировать следующим образом.
Минеральные соли.
| Бинарные соединения | Сульфиды, галогениды |
| Соли с анионом, содержащим неметалл (металлоид) | Карбонаты, сульфаты, фосфаты, нитраты, бораты, арсенаты, силикаты, алюмосиликаты. |
| Соли с анионом, содержащим металл | Хроматы, вольфраматы, молибдаты, ванадаты. |
Физические свойства

В обычных условиях все соли – это твердые бесцветные вещества. Но некоторые ионы придают им окраску. Например, соли двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.
Растворимость солей может быть различной. Хорошо растворимы нитраты, почти все соли щелочных металлов и аммония.
Химические свойства солей
1. Взаимодействие с металлами.
Более активные восстановители вытесняют менее активные из раствора их солей. Активность метала можно определить в электрохимическом ряду напряжения металлов.
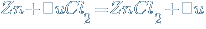
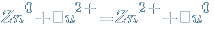
Однако щелочные и щелочноземельные металлы реагируют с растворами солей иначе.
Эти металлы сначала реагируют с водой. При этом образуется щелочь и выделяется водород.
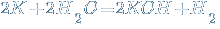 ↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
 ↓
↓ 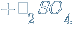
2. Реагируют со щелочами.
 ↓
↓ 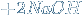
Реакция с кислотами (если образуется осадок или газ)
 ↓
↓  (качественная реакция на галогеноводородные кислоты.)
(качественная реакция на галогеноводородные кислоты.)
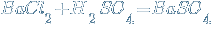 ↓
↓  (качественная реакция на серную кислоту и её соли.)
(качественная реакция на серную кислоту и её соли.)
|
|
 ↑ (качественная реакция на карбонаты)
↑ (качественная реакция на карбонаты)