Ответ.
Имеем: Mg, H2O, CaCO3
2H2O эл.ток; NaOH ® 2H2 + O2;
CaCO3 t® CaO + CO2;
CO2 + 2H2 t® C + H2O
CaO + 3C t® CaC2 + CO;
CaC2 + H2O ® Ca(OH)2 + C2H2;
3C2H2 t, C акт. ®  ;
;
2Мg + 3C t® Мg2C3;
Мg2C3 + H2O ® C3H4 (пропин) + 2Mg(OН)2;
C3H4 + H2  C3H6;
C3H6;
 +
+ 

 ;
;
 + O2 (воздух)
+ O2 (воздух) 
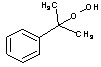 ;
;
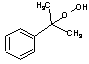

 +
+  .
.
III. Задача о влиянии водородной связи на свойства веществ(20 баллов). КАЗАНЬ
Водородная связь – форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом, например, O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
Водородная связь – вид химического внутри- или межмолекулярного взаимодействия атомов, отличающийся тем, что существенное участие в нѐм принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом (А). Группа А-Н одной молекулы (или еѐ части) выступает донором протона (акцептором электрона), а группа (или атом) другой молекулы (или еѐ части) В – донором электрона (акцептором протона). Иначе говоря, группа А-Н проявляет функцию кислоты, а группа В – основания. Для обозначения водородной связи употребляют, в отличие от обычной валентной чѐрточки, пунктир, т.е. А-Н···В.
К образованию водородной связи способны группы А-Н, где А – атомы О, N, F, Cl, Вr и, в меньшей мере, С и S. В качестве второго, электронодонорного центра В могут выступать те же атомы О, N, S разнообразных функциональных групп, анионы F-, С1- и др., в меньшей мере – ароматические кольца и кратные связи. Если А-Н и В принадлежат отдельным (разнородным или идентичным) молекулам, то водородную связь называют межмолекулярной, а если они находятся в разных частях одной молекулы, – внутримолекулярной.
От общих для всех веществ ван-дер-ваальсовых сил взаимного притяжения молекул водородная связь отличается направленностью и насыщаемостью, т.е. качествами обычных (валентных) химических связей. Водородная связь не сводится, как ранее считали, к электростатическому притяжению полярных групп А-Н и В, а рассматривается как донорно-акцепторная химическая связь. По своим энергиям, обычно 3-8 ккал/моль, водородная связь занимает промежуточное положение между ван-дер-ваальсовыми взаимодействиями (доли ккал/моль) и типичными химическими связями (десятки ккал/моль) (1 ккал = 4,19·103·Дж).
Наиболее распространены межмолекулярные водородные связи. Они приводят к ассоциации одинаковых или разнородных молекул в разнообразные агрегаты-комплексы с водородными связями, или Н-комплексы, которые при обычных условиях находятся в быстро устанавливающемся равновесии. При этом возникают как бинарные комплексы (кислота – основание и циклические димеры), так и большие образования (цепи, кольца, спирали, плоские и пространственные сетки связанных молекул). Наличием таких водородных связей обусловлены свойства различных растворов и жидкостей (в первую очередь, воды и водных растворов, ряда технических полимеров – капрона, нейлона и т.д.), а также кристаллическая структура многих молекулярных кристаллов и кристаллогидратов неорганических соединений, в том числе, разумеется, и льда. Точно также водородная связь существенно определяет структуру белков, нуклеиновых кислот и других биологически важных соединений и поэтому играет важнейшую роль в химии всех жизненных процессов. Вследствие всеобщей распространѐнности водородной связи еѐ роль существенна и во многих других областях химии и технологии (процессы перегонки, экстракции, адсорбции, хроматографии, кислотно-основные равновесия, катализ и т.д.).
?1. Некоторые из нижеприведенных соединений участвуют в образовании водородных связей, что влияет на их температуру кипения. Какое вещество в каждой паре более высококипящее? Ответ поясните.
А) CH3CO2H, CH3CHO; Б) CH3CH2OH, CH3CH2CH3; С) 2-HOC6H4CHO, 3-HOC6H4CHO.
?2. Посредством водородной связи между молекулами спирта и фенола могут образовываться различные типы димерных ассоциатов. Изобразите возможные типы димеров в спиртовом растворе фенола. В каком случае водородная связь наиболее прочная?
?3. Как изменяется кислотность 2-, 3-, 4-гидроксиацетофенонов (2-HOC6H4C(O)CH3, 3-HOC6H4C(O)CH3, 4-HOC6H4C(O)CH3) по сравнению с фенолом? Какое влияние оказывает на кислотность внутримолекулярная водородная связь?



О-11-6-1. Органическое вещество А, содержащее один атом кислорода, реагирует как с натрием, так и с гидроксидом натрия с образованием вещества Б, которое под действием бромной воды превращается в вещество В, содержащее 65,4% брома. Установите формулы веществ А-В. Напишите уравнения реакций Б с угольной кислотой (1), бромэтаном (2) и хлорангидридом уксусной кислоты (3).
Решение:
Химические свойства вещества А говорят о его принадлежности к классу фенолов.
Для определения структуры А воспользуемся данными о его бромировании.
Рассмотрим три варианта:
1)вещество В содержит 1 атом брома, тогдаM(В) = 80/0,695 = 115 г/моль, на остаток помимо брома приходится 115 – 80 = 35 г/моль, что не имеет решений для фенолов;
2)вещество В содержит 2 атома брома, тогда M(В) = 60/0,695 = 230 г/моль, на остаток помимо брома приходится 230 – 160 = 70 г/моль, что не имеет решений для фенолов;
3)вещество В содержит 3 атома брома, тогда M(В) = 240/0,695 = 345 г/моль, на остаток помимо брома приходится 345 – 240 = 105 г/моль – решение имеется. Молекулярный вес 2,4,6-трибромфенола равняется 331 г/моль, что отличается от вещества В на 14 г/моль, т.е. на группу СН2. Вещество А – один из изомеров метилфенола, а именно 3-метилфенол (мета -крезол), поскольку только он может образовать трибромпроизводное.

Уравнения реакций:

О-11-6-2. Органическое вещество А, содержащее один атом кислорода, реагирует как с натрием, так и с гидроксидом натрия с образованием вещества Б, которое под действием бромной воды превращается в вещество В, содержащее 63,0% брома. Установите формулы веществ А-В. Напишите уравнения реакций Б с угольной кислотой (1), иодметаном (2) и уксусным ангидридом (3).
Химические свойства вещества А говорят о его принадлежности к классу фенолов.
Для определения структуры А воспользуемся данными о его бромировании.
Рассмотрим три варианта:
1)вещество В содержит 1 атом брома, тогда M(В) = 80/0,668 = 119,7 г/моль, на остаток помимо брома приходится 119,7 – 80 = 39,7 г/моль, что не имеет решений для фенолов;
2)вещество В содержит 2 атома брома, тогда M(В) = 160/0,668 = 239,5 г/моль, на остаток помимо брома приходится 239,5 – 160 = 79,5 г/моль, что не имеет решений для фенолов;
3)вещество В содержит 3 атома брома, тогда M(В) = 240/0,668 = 359,3 г/моль, на остаток помимо брома приходится 359,3 – 240 = 109,3 г/моль – решение имеется. Молекулярный вес 2,4,6-трибромфенола равняется 331 г/моль, что отличается от вещества В на 28 г/моль, т.е. на группу С2Н4 или на две группы СН2.
Вариант 1. Вещество А – один из изомеров этилфенола, а именно 3-этилфенол, поскольку только он может образовать трибромпроизводное.

Вариант 2. Вещество А – один из изомеров диметилфенола, а именно 3,5-диметилфенол, поскольку только он может образовать трибромпроизводное.

Любое из этих двух решений является правильным.
Уравнения реакций (для 3-этилфенола):
