В процессе изучения химии приходится встречаться с классификациями химических реакций по различным признакам (табл.1).
Таблица 1 - Классификация химических реакций
| По тепловому эффекту | Экзотермические – протекают с выделением энергии 4Р + 5О2 = 2Р2О5 + Q; CH4 + 2О2 → СО2 + 2H2O + Q |
Эндотермические– протекают с поглощением энергии
Cu(OH)2  CuO + H2O – Q; C8H18 CuO + H2O – Q; C8H18  C8H16 + H2 – Q C8H16 + H2 – Q
| |
| По числу и составу исходных и образовавшихся веществ | Реакции разложения – из одного сложного вещества образуется несколько более простых:
СаСО3  СаО + СО2 C2H5OH → C2H4 + H2O СаО + СО2 C2H5OH → C2H4 + H2O
|
| Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное: 2H2 + О2 → 2H2O C2H4 + H2 → C2H6 | |
| Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе: Zn + 2HCl = ZnCl2 + H2↑ CH4 + Cl2 → CH3Cl + HCl | |
| Реакции обмена – два сложных вещества обмениваются составными частями: AgNO3 + HCl = AgCl↓ + HNO3 HCOOH + CH3OH → HCOOCH3 + H2O | |
| По агрегатному состоянию реагирующих веществ | Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях: Fe(т) + CuCl2(р-р) → Cu(т) + FeCl2(р-р) 2Na(т) + 2C2H5OH(ж) → 2C2H5ONa(р-р) + H2(г) ↑ |
| Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии: H2(г) + Cl2(г) = 2HCl(г) C2H5OH(ж) + CH3COOH(ж) → CH3COOC2H5(ж) + H2O(ж) | |
| По наличию катализатора | Каталитические 2H2O2  2H2O + О2↑ C2H4 + H2 2H2O + О2↑ C2H4 + H2  C2H4 C2H4
|
Некаталитические S + О2  SO2 C2H2 + 2Cl2 → C2H2 Cl4 SO2 C2H2 + 2Cl2 → C2H2 Cl4
| |
| По направлению | Необратимые – протекают в данных условиях только в одном направлении: H2SO4 + BaCl2 → BaSO4+ 2HCl CH4 + 2О2 → СО2 + 2H2O |
| Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях: 3H2 + N2 ↔ 2NH3; C2H4 + H2 ↔ C2H6 | |
| По изменению степени окисления атомов элементов | Окислительно-восстановительные – реакции, идущие с изменением степени окисления: Fe0 + 2H+1Cl-1 → Fe2+Cl2-1 + H20 H+1C0O-2 H+1 + H2 → C-2 H3+1 O-2 H+1 |
| Неокислительно-восстановительные – реакции, идущие без изменения степени окисления: S+4O4-2 + H2O → H2+ S+4O4-2 CH3NH2 + HCl → (CH3NH3)Cl |
Как видим, существует различные способы классификации химических реакций, из которых более подробно мы рассмотрим следующие.
По признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций (рис.6): реакции соединения, реакции разложения, реакции обмена, реакции замещения.
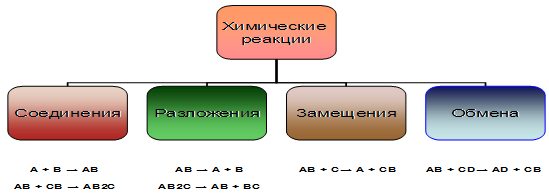
Рисунок 6 – Классификация химических реакций по признаку изменения числа исходных и конечных веществ
Приведем примеры таких реакций. Для этого воспользуемся уравнением получения гашеной извести и уравнению получения негашеной извести
СаО + Н2О = Са(ОН)2
Са(ОН)2 = СаО + Н2О
Эти реакции относятся к разным типам химических реакций.
Первая реакция является типичной реакцией соединения, поскольку при ее протекании две молекулы реагентов СаО и Н2О соединяются в одну, более сложную молекулу Са(ОН)2.
Вторая реакция Са(ОН)2 = СаО + Н2О является типичной реакцией разложения: здесь реагент Ca(OH)2 разлагается с образованием двух других, более простых веществ (продуктов реакции).
В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr2 с раствором HF выпадает осадок. Происходит реакция, в которой ионы кальция и водорода обмениваются между собой ионами брома и фтора
CaBr2 + 2HF = CaF2¯ + 2HBr
При сливании растворов CaCl2 и Na2CO3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO32- и Cl–
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка (¯) или газа (), например:
Zn + 2HCl = H2 + ZnCl2
Последняя реакция относится к еще одному типу химических реакций - реакциям замещения. Цинк заместил водород в его соединении с хлором - в HCl. Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе, например
2NaBr + Cl2 = 2NaCl + Br2 – это реакция замещения;
в левой части уравнения есть простое вещество-молекула хлора Cl2, и в правой части есть простое вещество – молекула брома Br2.
В реакциях обмена - и реагенты и продукты являются сложными веществами, например
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl – это реакция обмена;
в этом уравнении реагенты и продукты - сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена - не единственное.
Рассмотрим способ классификации по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (т.е. не окислительно-восстановительные).

Рисунок 7 – Реакции с изменением степени окисления элементов
Так, рассмотренная выше реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией, потому что в ней изменяются степени окисления реагирующих веществ
Zn0 + 2H+1Cl = H20 + Zn+2Cl2
это реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также:
- реакции метана с кислородом (рис. 1):
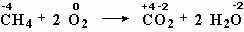
меняют степень окисления углерод и кислород;
- реакция оксида меди с водородом:
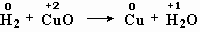
меняют степень окисления водород и медь;
- реакция бромида натрия с хлором:
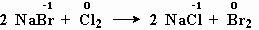
меняют степень окисления бром и хлор.
Важно также отметить, что по разным признакам одна и та же реакция может быть отнесена одновременно к нескольким типам, например
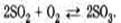
- эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.
К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество.
В более обобщенном варианте (уже с учетом и органической химии): все реакции с участием простых веществ, и наоборот, к реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
К окислительно-восстановительным относятся подавляющее большинство химических реакций, они играют исключительно важную роль.