1. Не взаимодействует с Н2.
2. Как активный металл реагирует почти со всеми неметаллами без нагревания, если снять оксидную пленку.
4Al + 3O2 → 2Al2O3
2Al + 3Cl2 → 2AlCl3
Al + P → AlP
3. Реагирует с Н2О:
Алюминий – активный металл с большим сродством к кислороду. На воздухе покрывается защитной пленкой оксида. Если пленку уничтожить, то алюминий активно взаимодействует с водой.
2Al + 6H2O 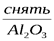 = 2Al(OH)3 + 3H2
= 2Al(OH)3 + 3H2
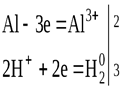
4. С разбавленными кислотами:
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
С концентрированными HNO3 и H2SO4 при обычных условиях не реагирует, а только при нагревании.
5. Со щелочами:
2Al + 2NaOH 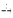 2NaAlO2 + 3H2
2NaAlO2 + 3H2
С водными растворами щелочей алюминий образует комплексы:
2Al + 2NaOH + 10 H2O = 2Na+[Al(OH)4(H2O)2]- + 3H2↑
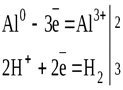
или Na[Al(OH)4],
Na3[Al(OH)6], Na2[Al(OH)5] – гидроксоалюминаты. Продукт зависит от концентрации щелочи.
4Al + 3O2 → 2Al2O3
Al2O3 (глинозем) встречается в природе в виде минерала корунда (по твердости близок к алмазу). Драгоценные камни рубин и сапфир – тоже Al2O3, окрашенный примесями железа, хрома
Оксид алюминия – амфотерен. При сплавлении его со щелочами получаются соли метаалюминиевой кислоты HAlO2. Например:
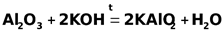 .
.
Также взаимодействует с кислотами
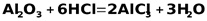 .
.
Белый студенистый осадок гидроксида алюминия растворяется как в кислотах
Al(OH)3 + 3HCl = AlCl3 + 3 H2O,
так и в избытке растворов щелочей, проявляет амфотерность
Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2]
При сплавлении со щелочами гидроксид алюминия образует соли метаалюминиевой или ортоалюминиевой кислот
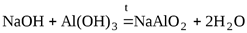
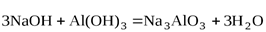 .
.
Аl(OH)3 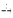 Al2O3 + H2O
Al2O3 + H2O
Соли алюминия сильно гидролизуются. Соли алюминия и слабых кислот превращаются в основные соли или подвергаются полному гидролизу:
AlCl3 + HOH ↔ AlOHCl2 + HCl
Al+3 + HOH ↔ AlOH+2 + H+ pH>7 протекает по I ступени, но при нагревании может протекать и по II ступени.
AlOHCl2 + HOH ↔ Al(OH)2Cl + HCl
AlOH+2 + HOH ↔ Al(OH)2+ + H+
При кипячении может протекать и III ступень
Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl
Al(OH)2+ + HOH ↔ Al(OH)3 + H+
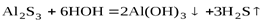
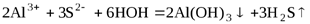 .
.
Соли алюминия хорошо растворимы.
AlCl3 – хлорид алюминия является катализатором при переработке нефти и различных органических синтезах.
Al2(SO4)3×18H2O – сульфат алюминия применяется для очистки воды от коллоидных частиц, захватываемых Al(OH)3 образовавшихся при гидролизе и снижении жесткости
Al2(SO4)3 + Ca(HCO3)2 = Al(OH)3 + CO2↑ + CaSO4↓
В кожевенной промышленности служит протравой при крошении хлопчатобумажных тканей – KAl(SO4)2×12H2O –сульфат калия-алюминия (алюмокалиевые квасцы).
Основное применение алюминия – производство сплавов на его основе. Дюралюмин – сплав алюминия, меди, магния и марганца.
Силумин – алюминий и кремний.
Основное их достоинство – малая плотность, удовлетворительная стойкость против атмосферной коррозии. Из алюминиевых сплавов изготавливают корпуса искусственных спутников Земли и космических кораблей.
Используется алюминий как восстановитель при выплавке металлов (алюминотермия)
Cr2O3 + 2 Al t = 2Cr + Al2O3.
Также применяют для термитной сварки металлических изделий (смесь алюминия и оксида железа Fe3O4) называемая термитом дает температуру около 3000°С.