ПОКАЗАНИЯ К ЭКО
Важный научно-практичесикий аспект программы ЭКО и ПЭ представляет изучениепатогенеза бесплодия.Абсолютными показаниями являются трубное бесплодие вследствие непроходимостиили отсутствия маточных труб. Относительные показания:§ предшествовавшие оперативные вмешательства (пластические операции)на маточных трубах у женщины в возрасте старше 30 лет, если после операциипрошло более года;§ некоторые формы эндометриоза;§ бесплодие неясного генеза;§ иммунологическое бесплодие при постоянно высоком уровнеантиспермальных антител.Существуют генетические критерии отбора для ЭКО. Метод не рекомендуется пригипоспадии, врожденных пороках сердца, шизофрении, аффективном психозе, приналичии в семье детей с аутосомно-рецессивными заболеваниями, риск повторногонаследования которых достигает 25 %. Противопоказаниями являются доминантнонаследуемые болезни.Большое внимание уделяется дальнейшему изучению патогенеза, профилактике илечению синдрома гиперстимуляции яичников (СГЯ), представляющего собойсерьезное осложнение, возникающее при проведении стимуляции суперовуляции.Важное значение в реализации программы ЭКО и ПЭ имеют исследования ролиэндокринных нарушений, их профилактика и коррекция.В предварительном обследовании потенциальных пациентов программы ЭКО и ПЭнеобходимо уделять большое внимание исследованию содержимого цервикальногоканала у женщины в целях диагностики инфекций, относящихся к так называемойгруппе TORCH-комплекса (трихомонады, краснуха, хламидии и др.). Должнаосуществляться не только их диагностика, но и лечение. Лишь пациенты,прошедшие соответствующую коррекцию, могут быть включены в программу ЭКО иПЭ.Необходима также тщательная кольпоскопия для исключения новообразований шейкиматки.За 2 – 3 мес. до ЭКО и ТЭ следует произвести тщательное обследование спермы,бактериологическое исследование и посев.Бесплодие у мужчин связано, как правило, с перенесенными иминеспецифическими инфекционными заболеваниями (краснуха, корь), а также снеправильным лечением ряда заболеваний, передаваемых половым путем, а такжевенерических (например, гонорея). Причиной бесплодия может быть крипторхизм.Ряд вредных действий внешней среды, как бытового, так и промышленногопроисхождения, может являться причиной нарушения сперматогенеза. ЭМБРИОЛОГИЧЕСКИЕ АСПЕКТЫПРОГРАММЫЭКО И ПЭ Эмбриологический этап программы ЭКО и ПЭ является одним из важнейших,поскольку оценка качества ооцитов, их оплодотворение и культивирование invitro до стадии преимплантационных эмбрионов во многом определяют ее успех.Ключевым моментом этого этапа программы является подбор адекватныхкультуральных сред и условий культивирования, приближающихся к естественнойсреде для преимплантационного развития. КУЛЬТУРАЛЬНЫЕ СРЕДЫ Культуральная среда для ЭКО должна быть максимально приближена по всемпараметрам к естественным жидкостям, в которых ооциты и эмбрионы человеканаходятся in vivo, т. е. маточных труб и матки. После овуляции яйцеклеткапопадает в маточную трубу (ампулярный отдел), где и происходитоплодотворение. Затем зигота и впоследствии эмбрион передвигается по трубев течение 4 - 5 дней, попадая в полость матки на стадии морулы.Практика показала, что многие среды, различающиеся по составу, могут успешноимитировать естественную среду для ооцитов и эмбрионов человека. Однакосуществует несколько основных характеристик, которым должны отвечатькультуральные среды. Уровень рН Уровень рН среды обычно должен равняться 7,4, что соответствует рН крови.Экспериментально было показано, что такая кислотность оптимальна дляоплодотворения и преимплантационного развития эмбрионов человека. В качествебуферной системы обычно используется бикарбонатный буфер в присутствии 5% CO2 в атмосфере. Этот буфер был выбран главным образом потому, что онсоответствует физиологической буферной системе крови, а парциальное давлениеCO2 в легких составляет 40 мм рт. ст., что соответствует 5%.Для индикации уровня рН во многих средах используется цветной индикатор –феноловый красный, меняющий окраску с фиолетовой (через красную и оранжевую)на желтую при закислении среды – изменении рН с 8,0 до 6,5. При рН 7,4 средас таким индикатором приобретает характерный красно-оранжевый цвет.Осмолярность
Важной характеристикой среды является ее осмолярность, определяемаяконцентрацией и константами диссоциации ее компонентов. Обычно осмолярностьравняется 285 мОсм/кг воды и соответствует таковой крови. Ооциты и эмбрионымлекопитающих обычно культивируются в открытых системах с максимальнодостижимой влажностью (80 - 90% в зависимости от модели CO2-инкубатора), что предотвращает сильные колебания осмолярности в процессекультивирования.Качество воды
Основой любой культуральной среды является вода, качество которой во многомопределяет успех культивирования. Для питательных сред используется вода,полученная после двойной дистилляции, ультрафильтрации либо деионизации. Приэтом необходимо соблюдение полной стерильности в процессе ее приготовленияи хранения. Эндотоксины, выделяемые бактериями, оставшимися в среде после ееультрафильтрации, могут оказать токсическое воздействие на эмбрионы.To жеможет произойти и при попадании бактерий в среду в процессе хранения.Ионный состав
Ионный состав культуральных сред может сильно варьировать. Первые среды длякультивирования ооцитов и эмбрионов млекопитающих представляли собоймодификацию раствора Кребса. Они содержали ионы, необходимые для поддержанияжизни клеток – Na+, К+, Са2+, Mg2+, и
и  , растворенные вбикарбонатном буфере (НCO3). Также добавлялись антибиотики дляпредотвращения бактериального заражения и источник белка в форме альбумина илисыворотки. Наиболее часто в качестве источника белка используется бычий иличеловеческий сывороточный альбумин, а также инактивированная человеческаясыворотка. Примерами таких сред могут служить Ml6, Т6, HTF (человеческаятрубная жидкость), EBSS (сбалансированный солевой раствор Эрла) и др. Болеесложные по составу среды, такие, как Ham's F10 и F12, aМЕМ, М199, хотя и былиразработаны для тканевых культур, но могут использоваться и для культивированияэмбрионов различных видов млекопитающих.Энергетическими субстратами для ооцитов и эмбрионов млекопитающих вкультуральной среде обычно служат пируват, лактат и глюкоза, причемусвоение глюкозы эмбрионы человека начинают лишь до прошествии несколькихклеточных делений, а до этого предпочтительным источником энергии служитпируват.Добавление аминокислот во многие культуральные среды объясняется ихприсутствием в жидкости яйцеводов многих видов млекопитающих. Было показано,что добавление глутамина в культуральную среду оказывает положительноевлияние на развитие эмбрионов многих видов млекопитающих. Однако привведении в среду аминокислот надо иметь в виду, что не все они остаютсястабильны в условиях культивирования – при температуре 37С многие из нихразрушаются, образуя аммоний, который при накоплении в среде обладаеттоксическим эффектом.Специально для культивирования эмбрионов Menezo с соавт. была разработанасреда В2, гораздо более сложная по составу: помимо солей, она содержитаминокислоты, витамины, нуклеотиды, микроэлементы и - в ряде случаев – дажежирные кислоты. Все эти среды применяются в практике ЭКО в различныхлабораториях. При том, что роль многих компонентов сложных сред до сих порне была убедительно показана, их применение дает хорошие результаты. CO2-ИНКУБАТОР Культивирование ооцитов и эмбрионов человека проводится в присутствии 5% CO3 в воздухе при температуре 37±0,1 °С и влажности 80 – 90%. Эти условиясоблюдаются при использовании CO3-инкубаторов, поддерживающихнеобходимую температуру, влажность и уровень CO2 в камере.Последний параметр поддерживается посредством подачи углекислого газа избаллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды.Углекислый газ для культивирования должен соответствовать медицинскимстандартам по чистоте. В некоторых клиниках применяется готовая газовая смесь, содержащая углекислый газ, азот и кислород в нужной пропорции. Влажность в камере CO3-инкубаторов поддерживается постояннымиспарением воды со дна камеры либо из специального лотка. Также в некоторыхсовременных инкубаторах имеется система инжекции воды в циркулирующий воздух,позволяющая автоматически поддерживать влажность в камере до 90%.В связи с высоким уровнем влажности в инкубаторах высок риск роста бактерийи плесени, поэтому необходима регулярная очистка всех поверхностей камеры.Как правило, для этой цели используют 70% этиловый спирт, однако делать этонадо с большой осторожностью, поскольку известно негативное влияниеэтилового спирта на ооциты и ранние эмбрионы. ИДЕНТИФИКАЦИЯ И ОЦЕНКА КАЧЕСТВА ООЦИТОВ Во время трансвагинальной пункции (ТВП) преовуляторных фолликулов вместе сфолликулярной жидкостью в пробирки попадают комплексы ооцит-cumulus. Cumulusoophorus (яйценосный бугорок) представляет собой часть фолликулярногоэпителия, непосредственно контактирующую с ооцитом в процессефолликулогенеза. Помимо прочего фолликулярная жидкость содержит фибриноген,что приводит к образованию кровяных сгустков уже через несколько минут послеаспирации. Если ооцит находится в таком сгустке, его будет достаточно сложнообнаружить и впоследствии отмыть. Для преодоления этой проблемы используютсядва основных подхода:1. Фолликулярную жидкость просматривают под микроскопом сразу послеаспирации и найденные ооциты незамедлительно помещают в среду для отмывки.2. Фолликулярную жидкость собирают в пробирки, содержащие среду сгепарином, предотвращающую образование кровяных сгустков.Как правило, в большинстве лабораторий руководствуются вторым подходом. Приэтом используется гепарин в концентрации 50 МЕ/мл. Этот раствор в объеме 1 млдобавляется в пробирки объемом 8 - 10 мл, что дает конечную концентрациюгепарина в фолликулярной жидкости 5 - 8 МЕ/мл. Известно, что гепарин неоказывает влияния на оплодотворение и последующее развитие эмбриона.Комплексы ооцит-cumulus перед помещением в культуральную среду обязательноотмывают в специальной среде.После того как аспирированная фолликулярная жидкость попадает вэмбриологическую лабораторию, она незамедлительно просматривается наприсутствие комплексов ооцит-cumulus. Для этого содержимое пробирокпереливается в чашки Петри диаметром 9 см и исследуется под стереомикроскопомили инвертированным микроскопом при небольшом увеличении. Как правило,комплексы ооцит-cumulus видны и невооруженным глазом как блестящие слизистыекомки или тяжи диаметром 0,5 – 1 см.Найденные ооциты помещаются в среду для отмывки, содержащую HEPES-буфер,позволяющий манипулировать с ооцитами на воздухе без риска изменения рН вщелочную сторону (такие среды производятся большинством фирм,специализирующихся на производстве сред для ЭКО), затем отмываются вкультуральной среде и помещаются в лунку 4-луночной чашки либо в специальнуючашку для ЭКО, где в дальнейшем будет проводиться оплодотворение ооцитов икультивирование эмбрионов.Также допускается культивирование в небольших (5 – 10 мкл) каплях среды,покрытых слоем минерального масла, предварительно эквилиброванного скультуральной средой в присутствии 5% С02. Преимуществамикультивирования под маслом являются: препятствование попаданию в культуральнуюсреду микроорганизмов и частичек пыли, возможность культивирования внебольших каплях среды, что важно при оплодотворении спермой с небольшойконцентрацией активных сперматозоидов, а также замедление испарения воды ивыхода CO2 из среды вне инкубатора. Однако, если капли со средойпод маслом слишком долго находились вне инкубатора, возвращение к исходномуравновесию влажности и концентрации CO2 займет гораздо большевремени, чем в отсутствие масла.Манипуляции с ооцитами проводят с помощью оттянутых стерильных пастеровскихпипеток, имеющих небольшую резиновую грушу на конце, либо стеклянных(пластиковых) капилляров, присоединенных к микроаспиратору. Существуют идругие способы манипуляций с ооцитами и эмбрионами – выбор зависит отопыта и желания эмбриолога.Сразу после помещения ооцитов в культуральную среду необходимо оценитьколичество, качество и степень зрелости полученных комплексов ооцит-cumulus. Классификация комплексов ооцит-cumulus, применяемая в клинике Bourn Hall, Кембридж
, растворенные вбикарбонатном буфере (НCO3). Также добавлялись антибиотики дляпредотвращения бактериального заражения и источник белка в форме альбумина илисыворотки. Наиболее часто в качестве источника белка используется бычий иличеловеческий сывороточный альбумин, а также инактивированная человеческаясыворотка. Примерами таких сред могут служить Ml6, Т6, HTF (человеческаятрубная жидкость), EBSS (сбалансированный солевой раствор Эрла) и др. Болеесложные по составу среды, такие, как Ham's F10 и F12, aМЕМ, М199, хотя и былиразработаны для тканевых культур, но могут использоваться и для культивированияэмбрионов различных видов млекопитающих.Энергетическими субстратами для ооцитов и эмбрионов млекопитающих вкультуральной среде обычно служат пируват, лактат и глюкоза, причемусвоение глюкозы эмбрионы человека начинают лишь до прошествии несколькихклеточных делений, а до этого предпочтительным источником энергии служитпируват.Добавление аминокислот во многие культуральные среды объясняется ихприсутствием в жидкости яйцеводов многих видов млекопитающих. Было показано,что добавление глутамина в культуральную среду оказывает положительноевлияние на развитие эмбрионов многих видов млекопитающих. Однако привведении в среду аминокислот надо иметь в виду, что не все они остаютсястабильны в условиях культивирования – при температуре 37С многие из нихразрушаются, образуя аммоний, который при накоплении в среде обладаеттоксическим эффектом.Специально для культивирования эмбрионов Menezo с соавт. была разработанасреда В2, гораздо более сложная по составу: помимо солей, она содержитаминокислоты, витамины, нуклеотиды, микроэлементы и - в ряде случаев – дажежирные кислоты. Все эти среды применяются в практике ЭКО в различныхлабораториях. При том, что роль многих компонентов сложных сред до сих порне была убедительно показана, их применение дает хорошие результаты. CO2-ИНКУБАТОР Культивирование ооцитов и эмбрионов человека проводится в присутствии 5% CO3 в воздухе при температуре 37±0,1 °С и влажности 80 – 90%. Эти условиясоблюдаются при использовании CO3-инкубаторов, поддерживающихнеобходимую температуру, влажность и уровень CO2 в камере.Последний параметр поддерживается посредством подачи углекислого газа избаллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды.Углекислый газ для культивирования должен соответствовать медицинскимстандартам по чистоте. В некоторых клиниках применяется готовая газовая смесь, содержащая углекислый газ, азот и кислород в нужной пропорции. Влажность в камере CO3-инкубаторов поддерживается постояннымиспарением воды со дна камеры либо из специального лотка. Также в некоторыхсовременных инкубаторах имеется система инжекции воды в циркулирующий воздух,позволяющая автоматически поддерживать влажность в камере до 90%.В связи с высоким уровнем влажности в инкубаторах высок риск роста бактерийи плесени, поэтому необходима регулярная очистка всех поверхностей камеры.Как правило, для этой цели используют 70% этиловый спирт, однако делать этонадо с большой осторожностью, поскольку известно негативное влияниеэтилового спирта на ооциты и ранние эмбрионы. ИДЕНТИФИКАЦИЯ И ОЦЕНКА КАЧЕСТВА ООЦИТОВ Во время трансвагинальной пункции (ТВП) преовуляторных фолликулов вместе сфолликулярной жидкостью в пробирки попадают комплексы ооцит-cumulus. Cumulusoophorus (яйценосный бугорок) представляет собой часть фолликулярногоэпителия, непосредственно контактирующую с ооцитом в процессефолликулогенеза. Помимо прочего фолликулярная жидкость содержит фибриноген,что приводит к образованию кровяных сгустков уже через несколько минут послеаспирации. Если ооцит находится в таком сгустке, его будет достаточно сложнообнаружить и впоследствии отмыть. Для преодоления этой проблемы используютсядва основных подхода:1. Фолликулярную жидкость просматривают под микроскопом сразу послеаспирации и найденные ооциты незамедлительно помещают в среду для отмывки.2. Фолликулярную жидкость собирают в пробирки, содержащие среду сгепарином, предотвращающую образование кровяных сгустков.Как правило, в большинстве лабораторий руководствуются вторым подходом. Приэтом используется гепарин в концентрации 50 МЕ/мл. Этот раствор в объеме 1 млдобавляется в пробирки объемом 8 - 10 мл, что дает конечную концентрациюгепарина в фолликулярной жидкости 5 - 8 МЕ/мл. Известно, что гепарин неоказывает влияния на оплодотворение и последующее развитие эмбриона.Комплексы ооцит-cumulus перед помещением в культуральную среду обязательноотмывают в специальной среде.После того как аспирированная фолликулярная жидкость попадает вэмбриологическую лабораторию, она незамедлительно просматривается наприсутствие комплексов ооцит-cumulus. Для этого содержимое пробирокпереливается в чашки Петри диаметром 9 см и исследуется под стереомикроскопомили инвертированным микроскопом при небольшом увеличении. Как правило,комплексы ооцит-cumulus видны и невооруженным глазом как блестящие слизистыекомки или тяжи диаметром 0,5 – 1 см.Найденные ооциты помещаются в среду для отмывки, содержащую HEPES-буфер,позволяющий манипулировать с ооцитами на воздухе без риска изменения рН вщелочную сторону (такие среды производятся большинством фирм,специализирующихся на производстве сред для ЭКО), затем отмываются вкультуральной среде и помещаются в лунку 4-луночной чашки либо в специальнуючашку для ЭКО, где в дальнейшем будет проводиться оплодотворение ооцитов икультивирование эмбрионов.Также допускается культивирование в небольших (5 – 10 мкл) каплях среды,покрытых слоем минерального масла, предварительно эквилиброванного скультуральной средой в присутствии 5% С02. Преимуществамикультивирования под маслом являются: препятствование попаданию в культуральнуюсреду микроорганизмов и частичек пыли, возможность культивирования внебольших каплях среды, что важно при оплодотворении спермой с небольшойконцентрацией активных сперматозоидов, а также замедление испарения воды ивыхода CO2 из среды вне инкубатора. Однако, если капли со средойпод маслом слишком долго находились вне инкубатора, возвращение к исходномуравновесию влажности и концентрации CO2 займет гораздо большевремени, чем в отсутствие масла.Манипуляции с ооцитами проводят с помощью оттянутых стерильных пастеровскихпипеток, имеющих небольшую резиновую грушу на конце, либо стеклянных(пластиковых) капилляров, присоединенных к микроаспиратору. Существуют идругие способы манипуляций с ооцитами и эмбрионами – выбор зависит отопыта и желания эмбриолога.Сразу после помещения ооцитов в культуральную среду необходимо оценитьколичество, качество и степень зрелости полученных комплексов ооцит-cumulus. Классификация комплексов ооцит-cumulus, применяемая в клинике Bourn Hall, Кембридж | Ооцит | Характеристика | |
| Очень незрелый | Клетки cumulus и corona radiata плотно упакованы вокруг ооцита. Иногда можно увидеть ядро ооцита - зародышевый пузырек. Такой ооцит находится на стадии профазы первого деления мейоза (GV-germinal vesicle stage), на которой происходит блок мейоза в процессе оогенеза. Полярное тельце еще не сформировалось | |
| Незрелый | Клетки corona radiata все еще плотно примыкают к ооциту, cumulus незначительно увеличился. Такой ооцит обычно находится на стадии метафазы первого деления мейоза (М I), блок мейоза уже снят, однако формирование полярного тельца пока не произошло | |
| Преовуляторный | Клетки corona radiala расходятся лучами от ооцита, cumulus разросшийся, но имеет клеточную структуру. Ооцит находится на стадии метафазы второго деления мейоза (М II), Полярное тельце уже сформировано | |
| Перезрелый | Присутствует небольшое количество клеток corona radiata, уже не примыкающих плотно к ооциту, который хорошо просматривается. Cumulus разросшийся, но все еще имеет клеточную структуру. Полярное тельце обычно хорошо видно | |
| Лютеинизированный | Вокруг ооцита клетки cumulus образуют скопления (комки), остальной cumulus представляет собой желеобразную массу с небольшим количеством клеток | |
| Дегенеративный | Несколько клеток гранупезы окружают ооцит, cumulus отсутствует или очень маленький. Ооцит обычно темноокрашен |
|
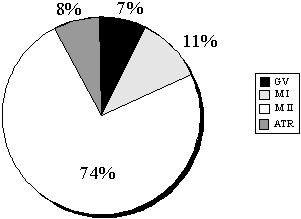
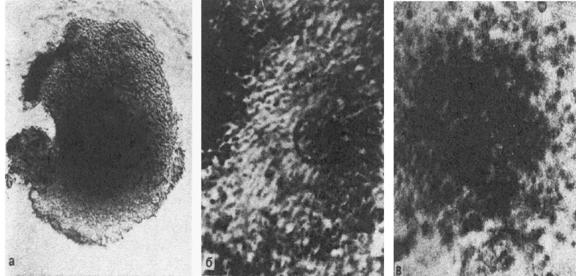 Рис.3. Ооцитарно-фолликулярные комплексы.а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектовв фазовом контрасте. ОБРАБОТКА СПЕРМЫПЕРЕД ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. Послеполного разжижения спермы, происходящего при комнатной температуре через 30 -60 мин, приступают к ее обработке. Предварительно необходимо провести анализконцентрации сперматозоидов, их подвижности и морфологических характеристикпо стандартной методике ВОЗ.Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимоее обработать в целях удаления семенной плазмы и получения максимальнополноценной фракции прогрессивно подвижных сперматозоидов. На практикеприменяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 –15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатантудаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. Послеудаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок,пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течениеэтого времени подвижные сперматозоиды должны мигрировать в наслоенную среду,оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Еслипробирки будут установлены наклонно, увеличится площадь контакта осадка сосредой и, соответственно, выход подвижных сперматозоидов. Для определенияконцентрации и подвижности сперматозоидов в надосадочной жидкости беретсяаликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации. Важным шагом вперед в методике обработки спермы стало внедрение методацентрифугирования в градиенте Перколла. Перколл представляет собой суспензиюсиликоновых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона(PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколлаявляется очень низкая осмолярность – 25 мОсм/л, поэтому при разведении всреде до различных концентраций, соответствующих различным плотностям (от1,01 до 1,13 г/л), осмолярность растворов остается постоянной. РастворыПерколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9частей Перколла и 1 части 10-кратно концентрированной среды для отмывки.Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-гоПерколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратнонаслаивается сперма (1 – 2 мл), и вся эта трехслойная колонкацентрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадокпопадают только функционально нормальные сперматозоиды; неподвижные ианомальные сперматозоиды, а также лейкоциты и другие клетки спермызадерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровскойпипеткой и два раза отмывается в специальной среде, как и в случаеприменения методики swim-up (см. выше).Последний метод, по мнению многих авторов, является более предпочтительным,сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов.Кроме того, описано и защитное действие Перколла: он не позволяет попасть восадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы,производящим большое количество свободных радикалов, способных повреждатьмембраны сперматозоидов. Таким образом, чем более благоприятно соотношениежизнеспособных сперматозоидов и дефектных, тем меньше вероятностьповреждений первых. ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro Много споров и разночтений вызывает вопрос о времени введения сперматозоидовв среду, где культивируются ооциты. Наиболее общепринятым считается, чтомежду выделением первого полярного тельца ооцита (достижением стадии М II) идобавлением спермы должно пройти около 4 ч, тогда способность такого ооцита коплодотворению и последующему дроблению будет максимальной.Преовуляторный фолликул на момент аспирации (обычно 36 ч после введенияхорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в моментовуляции при естественном цикле), как правило, содержит ооцит на стадии МII. В естественных условиях овуляция, а значит, и возможность оплодотворениянаступает через 38 - 40 ч после пика ЛГ.На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч.Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дроблениеэмбрионов и беременность разноречивы. По данным К. Yanagida с соавт.,исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 чперед оплодотворением (применялся метод интрацитоплазматическоймикроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов коплодотворению, последующему дроблению и имплантации статистическидостоверно снижается при инкубации их более 9 ч. Достоверных различий приинкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании былопоказано, что инкубация более 9 ч перед оплодотворением наиболее оптимальнадля последующего прохождения всех вышеуказанных процессов при ИКСИ;исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита,необходимым для его активации при оплодотворении.Важным моментом в обеих работах является то, что инкубация ооцитовпроисходила в присутствии клеток cumulus и corona radiata. Известно, чтосозревание ооцита полностью зависит от окружающих клеток фолликулярногоэпителия, поставляющих в ооплазму РНК и белки, необходимые для развитиябудущего организма до включения его собственного генома, а также белковыефакторы, отвечающие за процесс оплодотворения. Было показано, что дозреваниеооцитов in Ditro со стадии GV до стадии МII при интактном cumulusпроисходило с большей вероятностью, причем последующее их оплодотворение идробление было лучше.Несмотря на расхождение данных, большинство авторов считает, чтопреинкубация обязательно необходима, а ее оптимальная длительностьподбирается эмпирически в каждой лаборатории. При этом окно оплодотворениядля зрелого ооцита достаточно широко, однако преждевременное оплодотворениенедозревших ооцитов может негативно повлиять на исход дробления и имплантацииэмбрионов.Помимо фактора времени, в инсеминации важным является и количественныйфактор. Количество прогрессивно подвижных сперматозоидов обычно должносоставлять 50 - 100 тыс. на 1 мл среды (при культивировании в относительнобольшом объеме среды) либо на ооцит (при культивировании в микрокаплях подминеральным маслом). Подбирая концентрацию сперматозоидов приоплодотворении ооцитов in vitro, нужно иметь в виду, что при добавлениименее 50 тыс. активно подвижных сперматозоидов на 1 мл частота оплодотворениябудет существенно снижена, а при использовании очень высоких концентрацийвозникают побочные эффекты: полиспермия (проникновение более одногосперматозоида в ооцит при оплодотворении), снижение жизнеспособностиполученных эмбрионов (за счет повреждения кислородными радикалами, припопадании погибающих или мертвых сперматозоидов, либо воздействияизбыточного количества литических акросомальных ферментов).Однако это правило реализуется лишь в случае нормальной морфологиисперматозоидов, при наличии необходимой концентрации активно подвижныхсперматозоидов в эякуляте, отсутствии дефектов акросомальной реакции илиотсутствии больших концентраций антиспермальных антител в сперме (MAR-тестменее 50%). При наличии этих и других отрицательных факторов, а также принеудаче оплодотворения в предыдущей попытке ЭКО концентрация сперматозоидовможет быть повышена путем снижения объема среды культивирования(культивирование в микрокаплях, соломках для криоконсервации,микрокапиллярах), однако это далеко не всегда приводит к желаемымрезультатам. Для облегчения проникновения сперматозоида в ооцит клеткиcumulus и corona radiata могут быть удалены ферментативно и механически,однако это повышает риск полиспермии.
Рис.3. Ооцитарно-фолликулярные комплексы.а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектовв фазовом контрасте. ОБРАБОТКА СПЕРМЫПЕРЕД ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. Послеполного разжижения спермы, происходящего при комнатной температуре через 30 -60 мин, приступают к ее обработке. Предварительно необходимо провести анализконцентрации сперматозоидов, их подвижности и морфологических характеристикпо стандартной методике ВОЗ.Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимоее обработать в целях удаления семенной плазмы и получения максимальнополноценной фракции прогрессивно подвижных сперматозоидов. На практикеприменяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 –15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатантудаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. Послеудаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок,пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течениеэтого времени подвижные сперматозоиды должны мигрировать в наслоенную среду,оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Еслипробирки будут установлены наклонно, увеличится площадь контакта осадка сосредой и, соответственно, выход подвижных сперматозоидов. Для определенияконцентрации и подвижности сперматозоидов в надосадочной жидкости беретсяаликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации. Важным шагом вперед в методике обработки спермы стало внедрение методацентрифугирования в градиенте Перколла. Перколл представляет собой суспензиюсиликоновых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона(PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколлаявляется очень низкая осмолярность – 25 мОсм/л, поэтому при разведении всреде до различных концентраций, соответствующих различным плотностям (от1,01 до 1,13 г/л), осмолярность растворов остается постоянной. РастворыПерколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9частей Перколла и 1 части 10-кратно концентрированной среды для отмывки.Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-гоПерколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратнонаслаивается сперма (1 – 2 мл), и вся эта трехслойная колонкацентрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадокпопадают только функционально нормальные сперматозоиды; неподвижные ианомальные сперматозоиды, а также лейкоциты и другие клетки спермызадерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровскойпипеткой и два раза отмывается в специальной среде, как и в случаеприменения методики swim-up (см. выше).Последний метод, по мнению многих авторов, является более предпочтительным,сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов.Кроме того, описано и защитное действие Перколла: он не позволяет попасть восадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы,производящим большое количество свободных радикалов, способных повреждатьмембраны сперматозоидов. Таким образом, чем более благоприятно соотношениежизнеспособных сперматозоидов и дефектных, тем меньше вероятностьповреждений первых. ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro Много споров и разночтений вызывает вопрос о времени введения сперматозоидовв среду, где культивируются ооциты. Наиболее общепринятым считается, чтомежду выделением первого полярного тельца ооцита (достижением стадии М II) идобавлением спермы должно пройти около 4 ч, тогда способность такого ооцита коплодотворению и последующему дроблению будет максимальной.Преовуляторный фолликул на момент аспирации (обычно 36 ч после введенияхорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в моментовуляции при естественном цикле), как правило, содержит ооцит на стадии МII. В естественных условиях овуляция, а значит, и возможность оплодотворениянаступает через 38 - 40 ч после пика ЛГ.На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч.Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дроблениеэмбрионов и беременность разноречивы. По данным К. Yanagida с соавт.,исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 чперед оплодотворением (применялся метод интрацитоплазматическоймикроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов коплодотворению, последующему дроблению и имплантации статистическидостоверно снижается при инкубации их более 9 ч. Достоверных различий приинкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании былопоказано, что инкубация более 9 ч перед оплодотворением наиболее оптимальнадля последующего прохождения всех вышеуказанных процессов при ИКСИ;исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита,необходимым для его активации при оплодотворении.Важным моментом в обеих работах является то, что инкубация ооцитовпроисходила в присутствии клеток cumulus и corona radiata. Известно, чтосозревание ооцита полностью зависит от окружающих клеток фолликулярногоэпителия, поставляющих в ооплазму РНК и белки, необходимые для развитиябудущего организма до включения его собственного генома, а также белковыефакторы, отвечающие за процесс оплодотворения. Было показано, что дозреваниеооцитов in Ditro со стадии GV до стадии МII при интактном cumulusпроисходило с большей вероятностью, причем последующее их оплодотворение идробление было лучше.Несмотря на расхождение данных, большинство авторов считает, чтопреинкубация обязательно необходима, а ее оптимальная длительностьподбирается эмпирически в каждой лаборатории. При этом окно оплодотворениядля зрелого ооцита достаточно широко, однако преждевременное оплодотворениенедозревших ооцитов может негативно повлиять на исход дробления и имплантацииэмбрионов.Помимо фактора времени, в инсеминации важным является и количественныйфактор. Количество прогрессивно подвижных сперматозоидов обычно должносоставлять 50 - 100 тыс. на 1 мл среды (при культивировании в относительнобольшом объеме среды) либо на ооцит (при культивировании в микрокаплях подминеральным маслом). Подбирая концентрацию сперматозоидов приоплодотворении ооцитов in vitro, нужно иметь в виду, что при добавлениименее 50 тыс. активно подвижных сперматозоидов на 1 мл частота оплодотворениябудет существенно снижена, а при использовании очень высоких концентрацийвозникают побочные эффекты: полиспермия (проникновение более одногосперматозоида в ооцит при оплодотворении), снижение жизнеспособностиполученных эмбрионов (за счет повреждения кислородными радикалами, припопадании погибающих или мертвых сперматозоидов, либо воздействияизбыточного количества литических акросомальных ферментов).Однако это правило реализуется лишь в случае нормальной морфологиисперматозоидов, при наличии необходимой концентрации активно подвижныхсперматозоидов в эякуляте, отсутствии дефектов акросомальной реакции илиотсутствии больших концентраций антиспермальных антител в сперме (MAR-тестменее 50%). При наличии этих и других отрицательных факторов, а также принеудаче оплодотворения в предыдущей попытке ЭКО концентрация сперматозоидовможет быть повышена путем снижения объема среды культивирования(культивирование в микрокаплях, соломках для криоконсервации,микрокапиллярах), однако это далеко не всегда приводит к желаемымрезультатам. Для облегчения проникновения сперматозоида в ооцит клеткиcumulus и corona radiata могут быть удалены ферментативно и механически,однако это повышает риск полиспермии.
ОПЛОДОТВОРЕНИЕ – ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
Оплодотворение представляет собой слияние двух гамет - ооцита исперматозоида, влекущее за собой слияние их гаплоидных наборов хромосом иразвитие нового организма. Зрелый ооцит к моменту оплодотворения представляет собой одну изнаиболее больших клеток организма - 110 - 120 мкм в диаметре, окруженнуюблестящей оболочкой (zona pellucida), несколькими слоями клеток лучистого венца(corona radiata) и большим числом клеток яйценосного бугорка (cumulusoophorus). К этому времени в ооците, как правило, уже завершилось первоеделение мейоза, в результате которого отделилось первое полярное тельце, авторое деление мейоза находится на стадии метафазы. Хромосомы располагаются вряд, образуя метафазную пластинку, непосредственно под полярным тельцем. Наэтой стадии в ооците происходит блок мейоза, который снимается лишь припроникновении сперматозоида. Зрелый сперматозоид имеет уплощенную грушевидную головку длиной около 6мкм и шириной в экваториальном сегменте около 4 мкм, состоящую главным образомиз ядра и акросомы, которая содержит литические ферменты и расположена в видешапочки над верхней половиной головки. Хвост сперматозоида имеет длину около 50мкм и начинается от головки в районе шейки, где расположены центриоль икомплекс митохондрий. Митохондрии отвечают за обеспечение энергией процессадвижения сперматозоида, осуществляемого хвостом. В структуре сперматозоида нетничего лишнего, все имеет только одну цель – доставить генетический материал,содержащийся в головке сперматозоида, в ооцит.Способность сперматозоида к оплодотворению in vivo или In vitro появляетсялишь после капацитации, под которой in vivo понимается весь комплексбиохимических и ультраструктурных изменений, которые претерпеваетсперматозоид, проходя путь через женский половой тракт до встречи с ооцитом.Эти изменения затрагивают в основном мембрану головки сперматозоида.Капацитация in vitro происходит во время обработки и инкубирования спермы дооплодотворения, однако она невозможна при отсутствии в средах для отмывки икультивирования альбумина.При оплодотворении in vivo в трубе присутствует лишь небольшое количествосперматозоидов, проделавших весь долгий путь от влагалища до ампулярногоотдела маточной трубы. Для нормального оплодотворения in vitro их необходимоне менее 50 тыс. на ооцит. Однако при подсчете количества сперматозоидов,непосредственно атакующих ооцит in vitro, их насчитывается до 2 - 3 тыс. Досих пор неясно, почему количество сперматозоидов должно быть так велико вискусственных условиях. Возможно, это объясняется недостаточнойфизиологичностью среды либо большим размером массы cumulus у ооцитов,получаемых при ТВП, чем in vivo.Прежде чем попасть в ооцит, сперматозоид должен преодолеть несколькобарьеров. Первым из них является cumulus, представляющий собой растянутыйматрикс, состоящий преимущественно из полигиалуроновой кислоты, с редкорасположенными клетками. Преодолеть этот барьер может только капацитированныйсперматозоид с интактной акросомой. По мере продвижения внутрь cumulusповедение сперматозоида изменяется: резко возрастает скорость, двумерныедвижения становятся трехмерными - наступает фаза гиперактивности. In vitroпервый барьер сперматозоидам помогает преодолевать фермент гиалуронидаза,выделяющаяся при разрушении акросом гибнущих сперматозоидов; однако такаяситуация не является физиологичной.После прохождения cumulus сперматозоид достигает zona pellucida, гдепроисходит его связывание с рецептором. В отличие от мышей, рецепторы zоnаpellucida которых давно выделены и охарактеризованы, таковые человека до сихпор точно не определены. Имеется предположение, что это так называемыйантиген к оплодотворению - FA-1, гликопротеин, который при добавлении всреду полностью блокирует связывание сперматозоидов с zona pellucida.Связывание сперматозоида возможно только при интактной акросоме и нормальнойморфологии головки, поскольку рецепторы сперматозоида к гопа pellucidaрасположены на акросоме. Затем происходит акросомная реакция - мембранаакросомы и цитоплазматическая мембрана ооцита сливаются, содержимое акросомы(главным образом, фермент акрозин, способный к локальному растворениюгликопротеинов, из которых состоит гопа pellucida) выбрасывается в местесвязывания с гопа pellucida и сперматозоид интенсивно продвигается сквозьоболочку ооцита, все еще находясь в фазе гиперактивности.Попадая в перивителлиновое пространство, сперматозоид прикрепляется крецепторам на мембране ооцита комплементарными рецепторами, расположеннымина экваториальной части головки под акросомой. Связывание сперматозоида срецепторами на плазматической мембране мгновенно вызывает так называемуюкортикальную реакцию - массовый экзоцитоз гранул, расположенных по периферииооцита (cortex}, что приводит к необратимым изменениям zona pellucida,делающим ее непроходимой для остальных сперматозоидов. Это является основныммеханизмом предотвращения полиспермии у млекопитающих. Далее начинаетсяпроцесс слияния мембран сперматозоида и ооцита, в результате которогосперматозоид целиком как бы заглатывается ооцитом (процесс очень напоминаетфагоцитоз).Сразу после слияния гамет ядерная мембрана сперматозоида разрушается,хроматин деконденсируется под влиянием факторов ооплазмы. Одним из этихфакторов, возможно, является так называемый фактор деконденсации ядрасперматозоида (SNDF). Ооцит также активируется, мейоз возобновляется,выделяется второе полярное тельце. Механизм активации ооцита пока изученнедостаточно, однако известно, что фактор активации выделяетсясперматозоидом. Ядерный материал ооцита окружается оболочкой - формируетсяженский пронуклеус. Вокруг хроматина сперматозоида формируется мужскойпронуклеус, в обоих пронуклеусах идет синтез ДНК. Мужской и женскийпронуклеусы начинают движение по направлению друг к другу и встречаются вцентре ооцита. Через несколько часов после встречи мембраны пронуклеусовразрушаются, и генетический материал обеих гамет сливается (сингамия). Наэтом этапе процесс оплодотворения завершается - возникает зигота. Хроматинзиготы конденсируется, и хромосомы подготавливаются к первому делениюдробления.На следующий день после аспирации ооциты переносят в лунку со свежейкультуральной средой и очищают от клеток лучистого венца пастеровскойпипеткой с оттянутым до диаметра 150 - 160 мкм кончиком и просматривают напредмет присутствия признаков оплодотворения. Пронуклеусы видны в ооците дажепри наблюдении в стереомикроскоп х 80. Они появляются, как правило, через 10- 16 ч после добавления сперматозоидов в среду с ооцитами и исчезают через 6- 8 ч после появления. Если присутствуют оба пронуклеуса - оплодотворениесчитается нормальным. Если их не удается обнаружить - оплодотворение несостоялось. Если виден один пронуклеус либо больше двух - произошлоаномальное оплодотворение.Примерно в 30% случаев в ооцитах после оплодотворения in vitro не выявляютсяпронуклеусы, что может быть связано как с несостоявшейся пенетрацией ооцита(низкая концентрация активных сперматозоидов, дефекты в механизмах адгезиисперматозоида, отсутствие рецепторов на zona pellucida и/или мембранеооцита), так и с незрелостью ооцита на момент оплодотворения, а также сналичием хромосомных аномалий у ооцита (диплоидия, анеуплоидия).При наличии в ооплазме одного пронуклеуса (около 3 - 6%) в половине случаевоплодотворение все же происходит, однако пронуклеусы формируются асинхронно.Происхождение таких зигот может быть различным: гиногенетическим (изооцита), андрогенетическим (из сперматозоида) либо возникшим в результатеслияния мужского и женского пронуклеусов. Отличить на практике этоневозможно, поэтому рекомендуется: во-первых, просматривать ооциты наследующий день после инсеминации несколько раз, чтобы избежать ошибки; во-вторых, не переносить в полость матки эмбрионы, полученные изоднопронуклеарных зигот.Полипронуклеарные зиготы - 3 и более пронуклеусов - составляют, как правило,5 - 10% от всех оплодотворенных ооцитов и возникают главным образом припроникновении в ооцит более одного сперматозоида (в случае добавленияизбыточного количества сперматозоидов при инсеминации, при дефектахкортикальной реакции, при незрелости или перезрелости ооцита). Также описаныслучаи неотделения второго полярного тельца после завершения мейоза,генетический материал которого формирует третий пронуклеус.Полипронуклеарные зиготы, как правило, не развиваются нормально, эмбрионы,полученные из таких зигот нельзя переносить в полость матки. В естественныхусловиях такие эмбрионы иногда имплантируются, однако чаще всего такаябеременность заканчивается выкидышем либо мертворождением.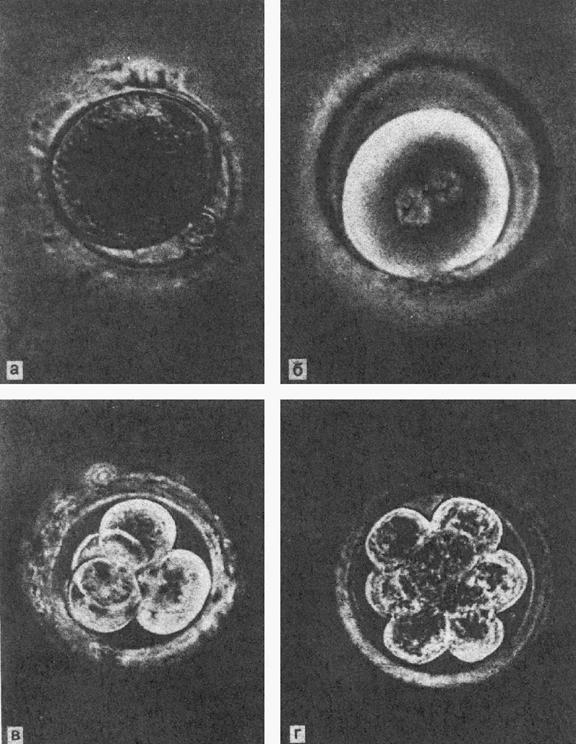 Рис. 4. Яйцеклетки и зародыши человека на различных этапах культивирования.а – ооцит с первым полярным тельцем; б – пронуклеусы: в и г – зародыши настадиях 4 и 8 бластомеров. Микрофотографии живых объектов в фазовомконтрасте. ОЦЕНКА КАЧЕСТВА ЭМБРИОНОВ Эмбрионы, полученные после оплодотворения ооцитов одной и той же пациентки,часто отличаются по скорости дробления и морфологическим параметрам.Общепризнанным считается, что максимальную способность к имплантации имеютэмбрионы с наибольшей скоростью дробления, бластомеры которых имеютрегулярную форму, а безъядерные фрагменты отсутствуют. Такие эмбрионы относятк классу 1 (А). Градация эмбрионов по качеству является условной иразличается в разных лабораториях. Однако в основе ее лежит, как правило,характер фрагментации эмбриона, форма и размер бластомеров. Так, эмбрион снеравными бластомерами и/или фрагментами цитоплазмы, занимающими менее 10%объема, соответствует классу 2 (В); при наличии фрагментации 10 - 50% -классу 3 (С), более 50% - классу 4 (D).Работы по анализу влияния качества переносимых в полость матки эмбрионов начастоту их имплантации многочисленны, но трудносопоставимы в силу разныхметодик оценки качества. Около 20% переносимых эмбрионов А-В классаимплантируются, однако эта частота падает до 1,5% для сильнофрагментированных эмбрионов. Впечатляют результаты клиники Bourn Hall(Англия), в которых показано, что 90% пациенток, забеременевших после ЭКО иПЭ, получали при переносе эмбрионов хотя бы один эмбрион класса А. В той жеработе не было выявлено зависимости между качеством переносимых эмбрионов ичастотой невынашивания беременности. СТРАТЕГИЯ ПЕРЕНОСА ЭМБРИОНОВ Количество переносимых эмбрионов обычно составляет не более 2 - 3, посколькупри увеличении числа эмбрионов до 4 и более частота беременности, какправило, не возрастает, но увеличивается риск моногоплодной беременности, чтовлечет за собой серьезные проблемы акушерского характера. Однако вотдельных случаях допускается перенос большего числа эмбрионов - примногократных неудачных попытках ЭКО и ПЭ и при возрасте пациентки старше 40лет. В данном случае при последующих переносах шанс наступления беременностиснижается, и авторы пытаются использовать возможность наступлениябеременности за счет увеличения количества переносимых эмбрионов. Но такойподход не является научным, так как в этих случаях не всегда ясна причинанеудач, т. е. мы часто имеем дело с так называемым «бесплодием неяснойэтиологии».Что касается интервала между моментом оплодотворения ооцитов и временемпереноса эмбрионов, то здесь существует несколько основных подходов. На зареразвития метода Эдварде и Стептоу переносили в полость матки эмбрионы,достигшие стадии 8 - 16 бластомеров на 3 - 4-е сутки культивирования,имитируя естественные условия. Однако впоследствии было выявлено, что болееранние эмбрионы также пригодны для переноса и имплантируются с той жевероятностью.Через 48 ч после аспирации фолликулов (2-е сутки культивирования) эмбрионы,как правило, находятся на стадии 2 - 4 бластомеров, но встречаются и стадии 6- 8 бластомеров. Перенос эмбрионов на 2-е сутки наиболее общепринят: ужеимеется возможность отобрать эмбрионы по качеству и скорости дробления,однако пребывание в условиях культуры, являющихся в любом случае менееоптимальными, чем естественные, еще не слишком длительно.Интересен тот факт, что способность эмбриона к имплантации напрямую зависитот скорости его дробления. Так, в исследовании Staessen с соавт. припереносе эмбриона хорошего качества на стадии 2 и 4 бластомеров частотаимплантации составила 14 и 21% соответственно. В другой работе сообщается,что если перенесенные эмбрионы достигали стадии не более 2 бластомеров,частота наступления беременности составляла 9,3%, но возрастала до 35,8%,если хотя бы один эмбрион был на более чем двуклеточной стадии.На 3-и сутки культивирования нормально развивающиеся эмбрионы достигаютстадии 6 - 8 бластомеров и выше. К этому моменту выбор эмбр
Рис. 4. Яйцеклетки и зародыши человека на различных этапах культивирования.а – ооцит с первым полярным тельцем; б – пронуклеусы: в и г – зародыши настадиях 4 и 8 бластомеров. Микрофотографии живых объектов в фазовомконтрасте. ОЦЕНКА КАЧЕСТВА ЭМБРИОНОВ Эмбрионы, полученные после оплодотворения ооцитов одной и той же пациентки,часто отличаются по скорости дробления и морфологическим параметрам.Общепризнанным считается, что максимальную способность к имплантации имеютэмбрионы с наибольшей скоростью дробления, бластомеры которых имеютрегулярную форму, а безъядерные фрагменты отсутствуют. Такие эмбрионы относятк классу 1 (А). Градация эмбрионов по качеству является условной иразличается в разных лабораториях. Однако в основе ее лежит, как правило,характер фрагментации эмбриона, форма и размер бластомеров. Так, эмбрион снеравными бластомерами и/или фрагментами цитоплазмы, занимающими менее 10%объема, соответствует классу 2 (В); при наличии фрагментации 10 - 50% -классу 3 (С), более 50% - классу 4 (D).Работы по анализу влияния качества переносимых в полость матки эмбрионов начастоту их имплантации многочисленны, но трудносопоставимы в силу разныхметодик оценки качества. Около 20% переносимых эмбрионов А-В классаимплантируются, однако эта частота падает до 1,5% для сильнофрагментированных эмбрионов. Впечатляют результаты клиники Bourn Hall(Англия), в которых показано, что 90% пациенток, забеременевших после ЭКО иПЭ, получали при переносе эмбрионов хотя бы один эмбрион класса А. В той жеработе не было выявлено зависимости между качеством переносимых эмбрионов ичастотой невынашивания беременности. СТРАТЕГИЯ ПЕРЕНОСА ЭМБРИОНОВ Количество переносимых эмбрионов обычно составляет не более 2 - 3, посколькупри увеличении числа эмбрионов до 4 и более частота беременности, какправило, не возрастает, но увеличивается риск моногоплодной беременности, чтовлечет за собой серьезные проблемы акушерского характера. Однако вотдельных случаях допускается перенос большего числа эмбрионов - примногократных неудачных попытках ЭКО и ПЭ и при возрасте пациентки старше 40лет. В данном случае при последующих переносах шанс наступления беременностиснижается, и авторы пытаются использовать возможность наступлениябеременности за счет увеличения количества переносимых эмбрионов. Но такойподход не является научным, так как в этих случаях не всегда ясна причинанеудач, т. е. мы часто имеем дело с так называемым «бесплодием неяснойэтиологии».Что касается интервала между моментом оплодотворения ооцитов и временемпереноса эмбрионов, то здесь существует несколько основных подходов. На зареразвития метода Эдварде и Стептоу переносили в полость матки эмбрионы,достигшие стадии 8 - 16 бластомеров на 3 - 4-е сутки культивирования,имитируя естественные условия. Однако впоследствии было выявлено, что болееранние эмбрионы также пригодны для переноса и имплантируются с той жевероятностью.Через 48 ч после аспирации фолликулов (2-е сутки культивирования) эмбрионы,как правило, находятся на стадии 2 - 4 бластомеров, но встречаются и стадии 6- 8 бластомеров. Перенос эмбрионов на 2-е сутки наиболее общепринят: ужеимеется возможность отобрать эмбрионы по качеству и скорости дробления,однако пребывание в условиях культуры, являющихся в любом случае менееоптимальными, чем естественные, еще не слишком длительно.Интересен тот факт, что способность эмбриона к имплантации напрямую зависитот скорости его дробления. Так, в исследовании Staessen с соавт. припереносе эмбриона хорошего качества на стадии 2 и 4 бластомеров частотаимплантации составила 14 и 21% соответственно. В другой работе сообщается,что если перенесенные эмбрионы достигали стадии не более 2 бластомеров,частота наступления беременности составляла 9,3%, но возрастала до 35,8%,если хотя бы один эмбрион был на более чем двуклеточной стадии.На 3-и сутки культивирования нормально развивающиеся эмбрионы достигаютстадии 6 - 8 бластомеров и выше. К этому моменту выбор эмбр