Занятие 7. 31.03.2017
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ СЕРЫ.
Вопросы для самоподготовки
- Какие кислородные соединения образуют сера, селен, теллур?
- Как можно получить оксиды серы (+4), селена (+4) и теллура (+4)?
- Какая из кислот имеет наибольшее значение степени диссоциации: H2SO3, H2SeO3, H2TeO3?
- Укажите различия между системами: водорода тетраоксосульфат(VI) и серная кислота. Как эти различия влияют условия на их свойства?
- От чего зависит термическая стабильность сульфатов?
- Нарисуйте графическую формулу тиосерной кислоты.
- Сравните кислотно-основные свойства водных растворов H2SO4, H2SeO4, H6TeO6, а также окислительно-восстановительные свойства индивидуальных соединений.
2 Литература для самоподготовки:
· Третьяков Ю.Д. Неорганическая химия: В 3 т. – М.: Академия, 2008. Том 2. С. 250-271.
· Глинка Н.Л. Общая химия: Учебное пособие для вузов. – М.: Интеграл-Пресс, 2004. – 728 с.
Лабораторная работа 7 по теме: «КИСЛОРОДНЫЕ СОЕДИНЕНИЯ СЕРЫ»
Все работы с халькогенами должны проводиться в вытяжном шкафу!
Опыт 1. Получение диоксида серы (сернистого ангидрида)
Опишите строение SO2 (МВС) и его свойства.
Какие продукты образуется при горении серы на воздухе?
а) Получение диоксида серы взаимодействием сульфитов с кислотами. Положите в пробирку немного сульфита натрия и добавьте 3 капли 70%-ного раствора серной кислоты. Напишите уравнение реакции и объясните направление смещения химического равновесия процесса. Как идентифицировать выделяющийся газ?
Б) Получение диоксида серы восстановлением концентрированной серной кислоты
Соберите установку по рис. 1.
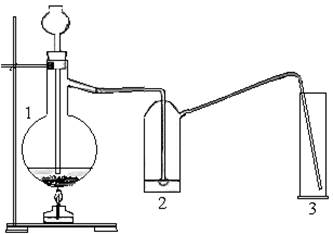
Рисунок 1 - Установка для получения диоксида серы
Налейте в промывалку (2) концентрированную H2SO4 (зачем?). Насыпьте в колбу Вюрца (1) 20 г медных стружек и залейте 96%-ным раствором серной кислоты. Нагрейте реакционную колбу (1) до выделения газа, который соберите в сухой цилиндр (3). Закройте цилиндр и оставьте для опыта 2. Напишите уравнение реакции.
Опыт 2. Растворимость диоксида серы в воде
Наполните кристаллизатор водой на ½ и добавьте 1-2 капли лакмуса. Наполненный диоксидом серы цилиндр (опыт 1) накройте стеклянной пластиной и переверните в кристаллизатор с водой. Выньте стеклянную пластину из воды. Почему вода стала подниматься в цилиндр, а образующийся раствор изменил окраску индикатора? Напишите уравнение реакции.
Какова растворимость SO2 в воде? Какие равновесия устанавливаются в системе? Какое строение имеет ион SO32-.
Укажите состав солей, последовательно образующихся при пропускании диоксида серы в раствор гидроокиси натрия?
Опыт 3. Восстановительные свойства диоксида серы
Налейте в пробирку 5 мл хлорной воды. Пропустите через раствор ток диоксида серы из установки опыта 1 или замените ток диоксида серы его раствором в воде. Что происходит? Напишите уравнения реакций.
Опыт 4. Окислительные свойства диоксида серы
Налейте в пробирку по 2 мл сероводородной воды и раствора диоксида серы (сернистой кислоты). Что наблюдается? Напишите уравнение реакции.
Сделайте общий вывод (оп.3 и 4) о причинах двойственности окислительно-восстановительных свойств SO2.
Опыт 5. Взаимодействие концентрированной серной кислоты с водой
Приведите строение молекулы водорода тетраоксосульфата (VI).
Налейте в стакан 10 мл воды и измерьте температуру. Не вынимая термометра, добавьте в систему 2 мл 96%-ного растворасерной кислоты. Отметьте изменение температуры. В каком порядке следует смешивать воду и концентрированный растворсерной кислоты?
Опыт 6. Действие концентрированной серной кислоты на органические вещества (ОПЫТ выполняется демонстрационно на лекции).
В стакан емкостью 50 мл поместите 10 г сахарной пудры, смочите ее водой до состояния густой кашицы и прилейте 3 мл концентрированного раствора серной кислоты. Интенсивно перемешайте массу стеклянной палочкой. Что наблюдается? Какие газообразные вещества образуются в результате процесса?
Напишите уравнение реакции.
Опыт 7. Взаимодействие концентрированной серной кислоты с простыми веществами
В две пробирки налейте по 2 мл 96%-ного раствора H2SO4и внесите в одну из них серу, а в другую – уголь. Осторожно нагрейте. Что происходит? Напишите уравнения реакций.
Изучите действие 96%-ного раствора H2SO4на порошки железа, цинка и меди (брать 0,5 г).
Замените концентрированный раствор H2SO4 на разбавленный. Сравните результаты, полученные при взаимодействии растворов H2SO4 различной концентрации с металлами. Объясните изменение свойств при переходе от концентрированного раствора H2SO4 к раствору с концентрацией менее 70%. Приведите сравнительную характеристику серной и сернистой кислот.