ПРИМЕРЫРЕШЕНИЯ ЗАДАЧ
Пример 1. Напишите формулу мицеллы золя, полученного сливанием равных объемов растворов 0,02Н AgNO3 и 0,01Н KCl. Приведите название всех слоев мицеллы. Укажите место возникновения дзета-потенциала (ζ-потенциала). Укажите заряд частицы.
Решение: В заданных условиях методом химической конденсации получается золь хлорида серебра: AgNO3 + KCl = AgCl¯ + KNO3
Поскольку электролит AgNO3 находится в системе в избытке, то ионы Ag+ будут для полученного золя потенциалопределяющими, а ионы NO3- ¾ противоионами.
Запишем формулу мицеллы золя:
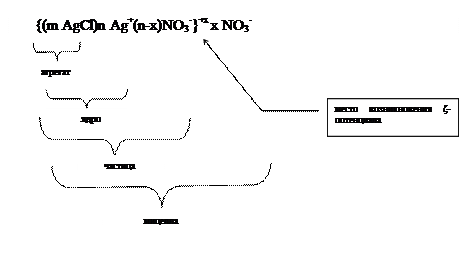
Пример 2. Порог коагуляции отрицательно заряженного гидрозоля металлического золота под действием NaCl равен 2,6×10-2 моль/л. C помощью закономерности Дерягина-Ландау рассчитайте пороги коагуляции, вызываемой следующими электролитами: K2SO4, MgCl2, MgSO4, FeCl3, Fe2(SO4)3.
Решение. Коагуляцию отрицательно заряженного гидрозоля золота вызывают противоионы, т. е. катионы электролитов. Соотношения порогов коагуляции разнозарядных ионов электролитов по Дерягину-Ландау равны: Ск(1): Ск(2): Ск(3) = 1:0,016:0,0014.
Электролит NaCl содержит 1 ион - коагулятор Na+ в молекуле NaCl, следовательно: Ск(1) = Ск(NaCl) = 2,6 × 10–2 моль/л.
Электролит-коагулятор K2SO4 содержит 2 иона-коагулятора К+ в молекуле K2SO4, следовательно: Ск(K2SO4) =  моль/л.
моль/л.
Электролит MgCl2 содержит 1 ион-коагулятор Мg2+ в молекуле MgCl2: Ск(MgCl2) = Ск(2) = Ск(1)·0,016 = 2,6·10-2·0,016 = 4,16·10-4 моль/л.
Электролит MgSO4 содержит 1 ион-коагулятор Мg2+ в молекуле MgSO4: Ск(MgSO4) = Ск(MgCl2) = 4,16·10-4 моль/л.
Электролит FeCl3 содержит 1 ион-коагулятор Fe3+ в молекуле FeCl3 Ск(FeCl3) = Cк(3) = Ск(1) × 0,0014 = 2,6·10-2·0,0014 = 3,64·10-5 моль/л.
Электролит Fe2(SO4)3 содержит 2 иона-коагулятора Fe3+ в молекуле
Fe2(SO4)3: Ск(Fe2(SO4)3) =  моль/л.
моль/л.
МНОГОВАРИАНТНЫЕ ЗАДАНИЯ
Задача 1.
Напишите формулы мицелл золей, полученных сливанием равных объемов растворов электролитов указанной концентрации. Приведите название всех слоев мицеллы. Укажите место возникновения дзета-потенциала (z). Укажите заряд частицы.
| Вариант | Электролит I | С1, моль/л | Электролит II | С2, моль/л |
| 1, 17 | KJ | 0,01 | AgNO3 | 0,001 |
| 2, 18 | KJ | 0,001 | AgNO3 | 0,01 |
| 3, 19 | KCl | 0,01 | AgNO3 | 0,001 |
| 4, 20 | KCl | 0,001 | AgNO3 | 0,01 |
| 5, 21 | AgNO3 | 0,03 | KBr | 0,001 |
| 6, 22 | NaBr | 0,001 | AgNO3 | 0,01 |
| 7, 23 | LiJ | 0,01 | AgNO3 | 0,005 |
| 8, 24 | AgNO3 | 0,05 | LiJ | 0,001 |
| 9, 25 | RbBr | 0,01 | AgNO3 | 0,0005 |
| RbBr | 0,0004 | AgNO3 | 0,01 | |
| BaCl2 | 0,01 | AgNO3 | 0,005 | |
| H2SO4 | 0,05 | H2SO4 | 0,1 | |
| FeCl3 | 0,1 | BaCl2 | 0,05 | |
| FeCl3 | 0,01 | K4[Fe(CN)6] | 0,01 | |
| FeCl3 | 0,01 | K4[Fe(CN)6] | 0,05 | |
| KJ | 0,1 | AgNO3 | 0,5 |
Задача 2.
Коллоидный раствор (золь) АД получен при смешивании V1 мл водного раствора АС с молярной концентрацией С1 и V2 мл водного раствора ВД с молярной концентрацией С2.
5. Напишите уравнение реакции и определите, какой из продуктов реакции образует золь.
6. Рассчитайте, какое из исходных веществ – АС или ВД – взято в избытке.
7. Напишите формулу мицеллы образовавшегося золя АД и укажите заряд коллоидной частицы (гранулы).
8. Для данных электролитов K2SO4, NaNO3, Na3PO4, MgCl2, CdSO4, Al2(SO4)3.
4.1. Определите, какой из ионов электролита будет вызывать коагуляцию, и расположите ионы в ряд в порядке уменьшения порога коагуляции.
4.2. Рассчитайте пороги коагуляции Ск в золе АД для каждого из предложенных электролитов, используя закономерность Дерягина-Ландау, если порог коагуляции гидрозоля АД под действием электролита KNO3 равен Ск.
| Вари- ант | АД | АС | V1, мл | С1, моль/л | ВД | V2, мл | С2, моль/л | Ск, моль/л |
| Fe(OH)3 | FeCl3 | 0,01 | KOH | 0,010 | 4,0×10-2 | |||
| H2SiO3 | HCl | 0,06 | Na2SiO3 | 0,015 | 9,2×10-3 | |||
| BaSO4 | BaCl2 | 0,03 | K2SO4 | 0,06 | 2,0×10-2 | |||
| PbI2 | Pb(NO3)2 | 0,01 | KI | 0,01 | 2,8×10-2 | |||
| ZnS | (NH4)2S | 0,05 | ZnCl2 | 0,01 | 4,5×10-2 | |||
| Hg2SO4 | H2SO4 | 0,02 | Hg2(NO3)2 | 0,01 | 9,8×10-3 | |||
| Be(OH)2 | BeCl2 | 0,01 | NH4OH | 0,02 | 4,8×10-2 | |||
| Ag2CrO4 | K2CrO4 | 0,03 | AgNO3 | 0,02 | 4,9×10-2 | |||
| Cr(OH)3 | CrCl3 | 0,01 | NH4OH | 0,02 | 5,0×10-2 | |||
| CdS | CdCl2 | 0,01 | H2S | 0,02 | 2,5×10-2 | |||
| PbSO4 | Pb(NO3)2 | 0,04 | H2SO4 | 0,03 | 3,9×10-2 | |||
| BaF2 | NaF | 0,02 | BaCl2 | 0,02 | 5,7×10-2 | |||
| Ag2C2O4 | AgNO3 | 0,01 | (NH4)2C2O4 | 0,03 | 4,7×10-2 | |||
| NiS | Na2S | 0,02 | NiSO4 | 0,01 | 4,9×10-2 | |||
| Mg(OH)2 | NaOH | 0,02 | MgCl2 | 0,03 | 3,2×10-2 | |||
| 16, 21 | HgI2 | Hg(NO3)2 | 0,05 | KI | 0,03 | 8,9×10-3 | ||
| 17, 22 | Fe3[Fe(CN)6]2 | FeSO4 | 0,04 | K3[Fe(CN)6] | 0,02 | 1,0×10-2 | ||
| 18, 23 | Bi(OH)3 | NaOH | 0,03 | Bi(NO3)3 | 0,01 | 1,9×10-2 | ||
| 19, 24 | Ag4[Fe(CN)6] | AgNO3 | 0,02 | K4[Fe(CN)6] | 0,03 | 3,4×10-2 | ||
| 20, 25 | Ag2SiO3 | Na2SiO3 | 0,01 | AgNO3 | 0,03 | 1,5×10-2 |