Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
Величина R/NА = k в уравнении (31) получила название постоянной Больцмана и представляет собой газовую постоянную, отнесенную к одной молекуле:
k = 1,38·10-23 Дж/К-23.
Так как 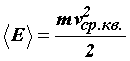 =
= 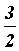 kТ, то средняя квадратичная скорость равна
kТ, то средняя квадратичная скорость равна
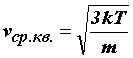 . (32)
. (32)
Подставляя значение средней кинетической энергии поступательного движения молекул (31) в основное уравнение молекулярно–кинетической теории газов, получим другую форму уравнения состояния идеального газа:
P = n0kT. (33)
Давление газа пропорционально произведению числа молекул в единице объема на его термодинамическую температуру.
Молярная масса - физическая величина, равная отношению массы вещества к количеству вещества.
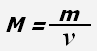
где M - молярная масса, m - масса вещества, ν - количество вещества.
Молярная масса численно равна массе одного моля вещества.
Единица измерения молярной массы - кг/моль.
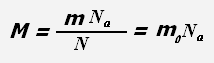
где Na = 6,022·1023 моль-1 - постоянная Авогадро,
N- число частиц системы, m0 - масса одной молекулы (для веществ атомарного строения - масса атома).
Масса молекулы равна отношению массы всего вещества к количеству молекул в веществе или отношению молярной массы к постоянной Авогадро.

Единица измерения массы молекулы - кг.
Средняя масса молекул 10-23 - 10 -26 кг. Например, масса молекулы воды - 3·10-26 кг.
Размер атома определяется расстоянием от центра ядра до орбит, на которых находятся валентные электроны или расстоянием от центра ядра до внешних заполненных электронных орбит.
Размер молекул - условная величина.
Эффективным диаметром молекулы называют расстояние предельного сближения центров двух молекул. Размеры молекулы порядка 10 -10 м. Например, эффективный диаметр молекулы воды примерно 4·10 -26 м.
Для молекул (атомов) веществ в твердом и жидком состоянии примерный объем одной молекулы (атома) равен отношению всего объема вещества к количеству молекул (атомов).
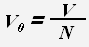
где V0 -объем молекулы или атома.
16) Идеальный газ - модель реального газа, согласно которой молекулы газа можно рассматривать как материальные точки, взаимодействие которых происходит только при столкновении. Реальный газ можно рассматривать как идеальный газ при выполнении условий:
· Столкновение молекул друг с другом и со стенками абсолютно упругое;
· Диаметр молекул много меньше среднего расстояния между ними
· Средняя кинетическая энергия молекул много больше средней потенциальной энергии их взаимодействия на расстоянии, больше диаметра молекул.
Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
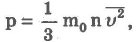
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы

можно записать:
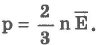
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
17) Агрегатное состояние вещества:
· Твердое – вещество находится в твердом состоянии, если средняя потенциальная энергия притяжения молекул много больше их средней кинетической энергии.
· Жидкое – вещество находится в жидком состоянии, если средняя кинетическая энергия молекул примерно равна средней потенциальной энергии их притяжения.
· Газообразное – вещество находится в газообразном состоянии, если средняя кинетическая энергия молекул превышает их среднюю потенциальную энергию.
· Плазменное – электронейтральная совокупность нейтральных и заряженных частиц.
18) Насыщенный пар находится в динамическом равновесии со своей жидкостью. Это состояние характеризуется тем, что число молекул, покидающих поверхность жидкости, равно в среднем числу молекул пара, возвращающихся в жидкость за то же время. Название пара — насыщенный — подчеркивает, что при данной температуре в данном объеме не может находиться большее количество пара. Если пар еще не достиг состояния динамического равновесия с жидкостью, он называется ненасыщенным.
Для насыщенного пара характерны следующие свойства:
— при постоянной температуре давление насыщенного пара не зависит от занимаемого объема;
— давление насыщенного пара при постоянном объеме увеличивается с ростом температуры., причем быстрее, чем у идеального газа при тех же условиях.
Количество водяного пара, содержащееся в 1 м3 воздуха, называется абсолютной влажностью воздуха. Относительная влажности воздуха, которая равна отношению парциального давления р водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара р0 при той же температуре (в процентах):
φ=р/р0*100%
Температуру, при которой относительная влажность достигает значения 100%, называют точкой росы. Если температура станет хоть немного ниже точки росы, пар начнет конденсироваться: появятся роса, туман.
Психро́метр. — прибор для измерениявлажности воздуха и его температуры.
Принцип действия
Скорость испарения влаги увеличивается по мере уменьшения относительной влажности воздуха. Испарение влаги, в свою очередь вызывает охлаждение объекта, с которого влага испаряется. По мере охлаждения влажного объекта уменьшается и скорость испарения влаги до тех пор пока при некоторой температуре не будет достигнуто динамическое равновесие - количество испарившейся влаги сравняется с количеством конденсирующейся. Таким образом температура влажного объекта (например термометра, обёрнутого во влажную ткань) даёт информацию об относительной влажности воздуха.
Для человека наиболее благоприятна относительная влажность 40 — 60%
19) Твердые тела сохраняют не только свой объем, как жидкости, но и форму. Твердые тела находятся преимущественно в кристаллическом состоянии.
Кристаллы – это твердые тела, атомы и молекулы которых занимают определенные упорядоченные положения в пространстве. Следствие этого – правильная внешняя форма кристалла.
Аморфными называют вещества, не обладающие в конденсированном состоянии кристаллическим строением, но обладающие, в отличие от жидкостей, упругостью формы (модуль сдвига не равен нулю).
В аморфном состоянии могут находиться, например обычные (неорганические) стекла, сера, селен, глицерин и большинство высокомолекулярных соединений.
У аморфных тел, в отличие от кристаллических, нет строгого порядка в расположении атомов. Только ближайшие атомы располагаются в некотором порядке. Но строгой повторяемости во всех направлениях одного и того же элемента структуры, которая характерна для кристаллов, в аморфных телах нет
Деформация твердого тела
Деформация и разрушение твердых тел под действием приложенных сил – это основные явления, определяющие механические свойства материалов.
Деформацией называется изменение формы или объема тела.
Жидкости сопротивляются изменению их объема, но не сопротивляются изменению формы. Твердые же тела сопротивляются как изменению формы, так и изменению объема. Они сопротивляются, как говорят, любому деформированию.
Деформации, которые полностью исчезают при прекращении действия внешних сил, называются упругими.
Деформации, которые не исчезают после прекращения действия внешних сил, называются пластическими.
Растяжение (сжатие)
Деформацию растяжения характеризуют абсолютным удлинением:
Благодаря большой сопротивляемости твердых тел, испытываемые ими под влиянием внешних сил деформации обычно невелики. При малом относительном удлинении деформации большинства тел упругие.