Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде частиц с определенной структурой. Насыщаемость связи тесно связана с понятием валентности, которая подразумевает способность атома данного элемента присоединять определенное число атомов другого элемента. В представлении метода ВС численное значение валентности соответствует числу ковалентных связей, которые образует рассматриваемый атом.
Различают следующие механизмы образования ковалентной связи: спин-валентный и донорно-акцепторный.
Спин-валентный механизм образования химической связи осуществляется парой электронов и предполагает взаимодействие орбиталей валентных электронов разных атомов с антипараллельными спинами. Например, образование молекулы водорода из атомов:
|
|
|
Н + Н → Н Н или более упрощенно:
Н × + × Н → Н: Н.
Поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле действия своего ядра, в образовании ковалентных связей принимают участие все одноэлектронные облака. Например, атомы кислорода и азота могут соединяться с двумя и тремя атомами водорода соответственно. В этом случае для образования связи каждый из атомов предоставляет по одному электрону.
В случае образования химической связи между атомами одного элемента, осуществляемой двумя или тремя парами электронов, связь является кратной и называется двойной или тройной соответственно. Например:


→ или (О = О)


→ или (N º N)
 Донорно-акцепторный механизм образования ковалентной связи возможен при взаимодействии частиц (атомов), одна из которых имеет свободную орбиталь, другая – пару электронов:
Донорно-акцепторный механизм образования ковалентной связи возможен при взаимодействии частиц (атомов), одна из которых имеет свободную орбиталь, другая – пару электронов:


+ →
Частица, предоставляющая для связи двухэлектронное облако, называется донором, частица со свободной орбиталью, принимающая электронную пару, называется акцептором. В рассмотренном случае молекула аммиака за счет пары электронов азота – донор, а ион водорода Н+, имеющий свободную орбиталь, – акцептор.
Электронные облака атомов имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают сигма (s), пи (p) и дельта (d) связи.
s-связи образуются при перекрывании облаков по линии, соединяющей ядра атомов:


s-s р-p s-p d-d
p-связи образуются при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов:



р-р d-р d-d
Направленность ковалентной связи обусловливается тем, что электронные облака атомов имеют определенную конфигурацию – расположение в пространстве. Часто в образовании связи участвуют орбитали разных конфигураций. Для объяснения того, как неравноценные по исходному состоянию орбитали образуют равноценные химические связи используются представления о гибридизации валентных орбиталей. Гибридизация сопровождается изменением формы и энергии электронных облаков, которое происходит при поглощении энергии и сопровождается образованием одинаковых по форме и энергии гибридных облаков (орбиталей). Понятно, что незначительные затраты энергии при таких изменениях окупаются при образовании равноценных связей. Гибридные орбитали изображают в виде неправильной сильно смещенной в одну сторону гантели.
Например, при смешивании одной s - и одной р -орбиталей происходит sp -гибридизация, за счет которой образуются две гибридные sр -орбитали. Эти орбитали в силу расталкивания расположены друг относительно друга под углом 180° .


→
(s + p)-орбитали две sр -орбитали
Комбинация трех орбиталей – одной s - и двух р -орбиталей приводит к sp 2 -гибридизации. Три sp 2-гибридные орбитали направлены к вершинам равностороннего треугольника под углом 120°.

→
(s + p + р)-орбитали три sp 2-орбитали
Комбинация четырех орбиталей – одной s - и трех р -типа – приводит к sp 3 -гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырем вершинам тетраэдра, т.е. под углом 109о28¢.


→
(s + p + р + р)-орбитали четыре sp 3-орбитали
В некоторых молекулах не все гибридные орбитали участвуют в образовании связи. Электронные пары, находящиеся на таких орбиталях, называются несвязывающими (или неподеленными). Например, в атоме кислорода молекулы воды две пары электронов являются несвязывающими:


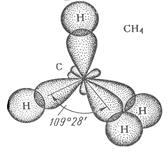
Схема sp 3-гибридных орбиталей в молекулах CH4, H3N, H2O
Связывающая электронная пара локализована между двумя атомами и поэтому занимает меньшее пространство, чем облако несвязывающей пары. Это определяет разную степень расталкивания гибридных орбиталей и приводит к уменьшению валентного угла по сравнению с углом, определяемым из типа гибридизации. Например, тип гибридизации во всех трех молекулах СН4, NH3, Н2О sp 3, а валентные углы разные.
Число гибридных орбиталей (тип гибридизации) зависит от того, какое соединение образует рассматриваемый атом.
 Чтобы определить тип гибридизации, вначале следует рассчитать стерическое число СЧ – общее количество сигма-связей атома и несвязывающих (неподеленных) электронных пар валентной оболочки.
Чтобы определить тип гибридизации, вначале следует рассчитать стерическое число СЧ – общее количество сигма-связей атома и несвязывающих (неподеленных) электронных пар валентной оболочки.
Первое слагаемое N σ – число «соседей» атома – число сигма-связей; второе слагаемое – число неподеленных электронных пар.
N гр – номер группы рассматриваемого атома в ПС – общее число электронов на валентных уровнях;
ne – степень окисления атома, образующего связь с рассматриваемым атомом – сколько электронов «забирает один сосед»;
N σ·ne – общее число валентных электронов рассматриваемого атома, затраченных на образование связей (и сигма, и пи);
qi - общий заряд частицы – сколько электронов добавилось извне к рассматриваемому атому (если частица – анион) или сколько их ушло (частица – катион).
Таким образом, в числителе второго слагаемого – число несвязывающих электронов; делением на 2 получаем число несвязывающих электронных пар.
СЧ равно числу гибридных орбиталей и указывает тип гибридизации.
Примеры расчета стерического числа:
• H2О; центральный атом – кислород
СЧ(О)= 2 + (6 – 2·1 – 0)/2 = 4 Þ sp3
• NH4+; центральный атом – азот
CЧ(N) = 4 + (5 - 4·1 – 1)/2 = 4 Þ sp3
• PCl5; центральный атом – фосфор
СЧ(P) = 5 + (5 - 5·1 + 0)/2 = 5 Þ sp3d
Модель Гиллеспи – теория взаимного отталкивания электронных пар – дополняет метод ВС в части пространственного расположения связей и неподеленных электронных пар. Основные положения теории:
- все электронные пары (и связывающие, и несвязывающие) располагаются вокруг атома в соответствии с принципом наименьшей энергии – т.е. на максимальном удалении друг от друга:
sp – на одной линии, угол между орбиталями 180°;
sp2 – по направлению к углам треугольника, угол 120°;
sp3 – по направлению к вершинам тетраэдра, угол 109о28¢;
sp3d – по направлению к вершинам тригональной бипирамиды, углы 120° и 90°.
sp3d2 – по направлению к вершинам октаэдра (тетрагональной бипирамиды), углы 90°.
- несвязывающая электронная пара занимает больший объем, чем связывающая;
- отталкивание несвязывающих электронных пар сильнее, чем связывающих, что приводит к некоторому отклонению значений углов между связями в несимметричных молекулах от теоретических, соответствующих направлениям гибридных орбиталей.
Основываясь на этих положениях, можно предсказать пространственную конфигурацию молекулы или молекулярного иона.
Полярность ковалентной связи объясняется различной электроотрицательностью атомов, образующих молекулу. Двухэлектронное облако сдвигается к более электроотрицательному атому, и в молекуле проявляется электрический момент диполя. В результате более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд. Эти заряды принято называть эффективными зарядами атомов в молекуле. Они могут иметь дробную величину. Например, в молекуле HСl эффективный заряд равен 0,17e (где е – заряд электрона):

Система из двух равных по величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга, называется электрическим диполем.
Чем больше различие в электроотрицательности двух элементов, тем больше связь отличается от ковалентной и тем больше в ней доля ионной связи.
Следует различать полярность связей и полярность молекул. Связи в молекуле могут быть полярными, а сами молекулы неполярными в случае высокой симметрии молекулы. Момент диполя в сложных молекулах представляет собой векторную сумму моментов связей групп и неподеленных пар этой молекулы.
Например, в плоской молекуле BF3 или в линейной молекуле BeCl2 сумма дипольных моментов связей равна нулю:

Нулевой дипольный момент имеют тетраэдрические молекулы CH4 и CBr4. Нарушение симметрии, например, в молекуле BF2Cl, обусловливает дипольный момент, отличный от нуля.
Пример: Определите пространственную структуру молекул CO2 и H2O.
Решение. В молекуле CO2 центральным является атом углерода, поэтому его орбитали подвергаются гибридизации. Сокращенная электронная формула:
C …2s22p2 
в возбужденном состоянии:
C* …2s12p3 
В образовании s-связей с атомами кислорода принимают участие один s- и один p-электрон атома углерода, что соответствует sp -гибридизации, которая определяет линейную структуру молекулы CO2. Оставшиеся два p-электрона расходуются на образование p-связей с атомами кислорода. Структура молекулы CO2 имеет вид:
O = C = O
В молекуле H2O центральным является атом кислорода. Сокращенная электронно-графическая формула атома кислорода:
O …2s22p4 
В образовании s-связей с двумя атомами водорода принимают участие два неспаренных p-электрона атома кислорода и еще остается две неподеленные электронные пары на s- и p-орбитали, то есть в гибридизации принимают участие одна s- и три p-орбитали, что соответствует sp3 -гибридизации атома кислорода. При образовании молекулы воды атомы водорода занимают две вершины тетраэдра, а к еще двум вершинам направлены электронные облака неподеленных пар атома кислорода. Угол связи HOH равен 104,5о, что несколько отличается от угла правильного тетраэдра, это связано с наличием неподеленных пар электронов. Строение молекулы воды можно представить следующей схемой:

Молекула воды имеет уголковую форму.