ГОРЕНИЕ ЖИДКИХ ВЕЩЕСТВ
Жидкости – это вещества в конденсированном состоянии, промежуточном между твердыми и газообразными. Жидкости, подобно твердым веществам, обладают малой сжимаемостью и большой плотностью, не обладают упругостью и легко текут. В жидкостях расстояние между молекулами – порядка размера самих молекул, а силы межмолекулярного взаимодействия весьма значительны.
Горючими называют жидкости, способные самовозгораться, а также возгораться от источника зажигания. Их можно разделить на индивидуальные вещества и смеси.
Физические свойства жидкостей
Текучесть
Основным свойством жидкостей является текучесть. Если к участку жидкости, находящейся в равновесии, приложить внешнюю силу, то возникает поток частиц жидкости в том направлении, в котором эта сила приложена: жидкость течёт. Таким образом, под действием неуравновешенных внешних сил жидкость не сохраняет форму и относительное расположение частей, и поэтому принимает форму сосуда, в котором находится.
В отличие от пластичных твёрдых тел, жидкость не имеет предела текучести: достаточно приложить сколь угодно малую внешнюю силу, чтобы жидкость потекла.
- Сохранение объёма
Одним из характерных свойств жидкости является то, что она имеет определённый объём (при неизменных внешних условиях). Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключенную в сосуд, передаётся без изменения в каждую точку объёма этой жидкости (закон Паскаля, справедлив также и для газов). Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах.
|
|
Жидкости обычно увеличивают объём (расширяются) при нагревании и уменьшают объём (сжимаются) при охлаждении. Впрочем, встречаются и исключения, например, вода сжимается при нагревании, при нормальном давлении и температуре от 0 °C до приблизительно 4 C.
- Вязкость
Кроме того, жидкости (как и газы) характеризуются вязкостью. Она определяется как способность оказывать сопротивление перемещению одной из частей относительно другой — то есть как внутреннее трение.
Когда соседние слои жидкости движутся относительно друг друга, неизбежно происходит столкновение молекул дополнительно к тому, которое обусловлено тепловым движением. Возникают силы, затормаживающие упорядоченное движение. При этом кинетическая энергия упорядоченного движения переходит в тепловую — энергию хаотического движения молекул.
Жидкость в сосуде, приведённая в движение и предоставленная самой себе, постепенно остановится, но её температура повысится.
- Образование свободной поверхности и поверхностное натяжение
Из-за сохранения объёма жидкость способна образовывать свободную поверхность. Такая поверхность является поверхностью раздела фаз данного вещества: по одну сторону находится жидкая фаза, по другую — газообразная (пар), и, возможно, другие газы, например, воздух.
Если жидкая и газообразная фазы одного и того же вещества соприкасаются, возникают силы, которые стремятся уменьшить площадь поверхности раздела — силы поверхностного натяжения. Поверхность раздела ведёт себя как упругая мембрана, которая стремится стянуться.
|
|
Поверхностное натяжение может быть объяснено притяжением между молекулами жидкости. Каждая молекула притягивает другие молекулы, стремится «окружить» себя ими, а значит, уйти с поверхности. Соответственно, поверхность стремится уменьшиться.
Поэтому мыльные пузыри и пузыри при кипении стремятся принять сферическую форму: при данном объёме минимальной поверхностью обладает шар. Если на жидкость действуют только силы поверхностного натяжения, она обязательно примет сферическую форму — например, капли воды в невесомости.
Маленькие объекты с плотностью, большей плотности жидкости, способны «плавать» на поверхности жидкости, так как сила тяготения меньше силы, препятствующей увеличению площади поверхности.
- Испарение и конденсация
Испарение — постепенный переход вещества из жидкости в газообразную фазу (пар).
При тепловом движении некоторые молекулы покидают жидкость через её поверхность и переходят в пар. Вместе с тем, часть молекул переходит обратно из пара в жидкость. Если из жидкости уходит больше молекул, чем приходит, то имеет место испарение.
Теплотой испарения называется определенное количество тепла, которое затрачивается при испарении. Теплота испарения зависит только от вида вещества.
Эту величину используют при расчетах для прогнозирования аварийных ситуаций (параметров взрыва) при разливе жидкостей, а также при определении категории помещений по взрыво- и пожарной опасности.
Испарению принадлежит исключительно важная роль, потому что в конечном итоге оно определяет скорость сгорания жидкости и интенсивность горения.
|
|
Скорость испарения определенной горючей жидкости зависит от условий теплообмена над поверхностью жидкости, а также от условий переноса тепла внутри самой жидкости.
Процесс испарения характеризуется следующими параметрами:
Скорость испарения — количество жидкости, испаряющейся со свободной поверхности в единицу времени.
Интенсивность испарения — количество жидкости, испаряющейся с единицы площади поверхности в единицу времени.
Интенсивность испарения зависит от:
· вида жидкости (теплоты испарение);
· температуры жидкости;
· атмосферного давления;
· скорости движения воздуха над поверхностью жидкости.
Статическое испарение происходит, если неподвижная жидкость испаряется в неподвижную газовую среду.
Динамическое испарение — если жидкость испаряется в движущуюся газовую среду. При одинаковой температуре скорость динамического испарения больше, чем статического.
Динамическое равновесие — состояние системы, при котором количество жидкости, которая испаряется, равняется количеству сконденсированного пара.
Пар, находящийся в состоянии динамического равно-весия с жидкостью, называется насыщенным паром.
Повышение температуры ускоряет процесс испарения, что приводит к образованию пожаровзрывоопасных концентраций паров над поверхностью жидкости.
Максимальная скорость испарения – испарение в вакуум или в неограниченный объем.
Насыщенный пар – это пар, находящийся в динамическом равновесии с жидкостью. Как правило, это характерно для замкнутых объемов.
Ненасыщенный пар – характерен для открытых емкостей. Давление на стенки сосудов.
Давление насыщенного пара зависитот температуры и свойств жидкости и не зависит от количества жидкости или площади испарения.
Численные значения давления насыщенного пара используют при:
• расчете количества испарившейся жидкости;
• определение степени пожарной опасности насыщенного пара горючей жидкости;
• расчете критических температур жидкости, в закрытом технологическом оборудовании.
Конденсация — обратный процесс, переход вещества из газообразного состояния в жидкое. При этом в жидкость переходит из пара больше молекул, чем в пар из жидкости.
Испарение и конденсация — неравновесные процессы, они происходят до тех пор, пока не установится локальное равновесие (если установится), причём жидкость может полностью испариться, или же прийти в равновесие со своим паром, когда из жидкости выходит столько же молекул, сколько возвращается.
- Кипение
Кипение — процесс парообразования внутри жидкости. При достаточно высокой температуре давление пара становится выше давления внутри жидкости, и там начинают образовываться пузырьки пара, которые (в условиях земного притяжения) всплывают наверх.
Для горючих жидкостей характерно то, что температура их кипения всегда ниже температуры самовоспламенения. Вследствие этого горение жидкостей возможное только в паровой фазе.
Сгорание образовавшегося пара, происходит практически немедленно после его смешивания с окружающим воздухом. Поэтому скорость выгорания жидкостей определяется скоростью испарения как наиболее медленным процессом.
Если кипение происходит при постоянном давлении, то температура жидкости остается постоянной, т.к. все подводимое тепло тратиться полностью на парообразование (рис. 1).
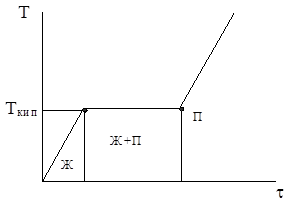
Рис. 1. Термограмма нагрева жидкости при P = const: Ткип – темпера-тура кипения.
С повышением давления в закрытом сосуде температура кипения возрастает. Например, ТКИП воды равно 1000С при P=101,3 кПа и ТКИП=1890С при P=1013 кПа (10 атм). Такая ситуация наблюдается, в частности, в паровых котлах, где существует вода в жидком виде при температуре выше 1000С (это так называемая перегретая вода), либо в кастрюле-скороварке (при РИЗБ=0,2 атм, ТКИП=1200С).
Если прекратить нагрев и расходовать пар, то кипение продолжается до снижения температуры до 1000С и атмосферного давления. Если же резко сбросить давление (например, при лопнувшей трубе котла), то перегретая вода мгновенно превращается в пар с резким скачком его давления и взрывом. Напротив, в условиях пониженного давления атмосферы температура кипения снижается. Это повышает взрывоопасность горючих жидкостей, из-за повышения интенсивности испарения и создания взрывоопасных концентраций паров.
Каждой температуре жидкости соответствует свое максимально возможное количество пара над жидкостью. Это так называемый насыщенный пар, т.е. пар, находящийся в равновесии с жидкостью. Давление такого пара называется упругостью насыщенного пара. Упругость насыщенного пара – это максимально возможное количество пара в воздухе над жидкостью при данной температуре, т.е. максимальное парциальное давление. При более высоком содержании пар начинает конденсироваться.
- Смачивание
Смачивание — поверхностное явление, возникающее при контакте жидкости с твёрдой поверхностью в присутствии пара, то есть на границах раздела трёх фаз.
Смачивание характеризует «прилипание» жидкости к поверхности и растекание по ней (или, наоборот, отталкивание и нерастекание). Различают три случая: несмачивание, ограниченное смачивание и полное смачивание.
- Смешиваемость
Смешиваемость — способность жидкостей растворяться друг в друге.
Диффузия
При нахождении в сосуде двух смешиваемых жидкостей молекулы в результате теплового движения начинают постепенно проходить через поверхность раздела, и таким образом жидкости постепенно смешиваются. Это явление называется диффузией (происходит также и в веществах, находящихся в других агрегатных состояниях).
- Перегрев и переохлаждение
Жидкость можно нагреть выше точки кипения таким образом, что кипения не происходит. Для этого необходим равномерный нагрев, без значительных перепадов температуры в пределах объёма и без механических воздействий, таких, как вибрация. Если в перегретую жидкость бросить что-либо, она мгновенно вскипает. Перегретую воду легко получить в микроволновой печи.
Переохлаждение — охлаждение жидкости ниже точки замерзания без превращения в твёрдое агрегатное состояние. Как и для перегрева, для переохлаждения необходимо отсутствие вибрации и значительных перепадов температуры.
Горение жидкостей имеет свои специфические особенности. Во-первых, горение горючего вещества происходит в смеси паров горючего вещества с кислородом воздуха над поверхностью жидкой фазы. Во-вторых, жидкость как таковая имеет относительно невысокую температуру в процессе горения паров. В-третьих, лимитирующей стадией горения является скорость испарения жидкости, а продолжение или прекращение горения зависит от соотношения скорости испарения топлива (υисп) и скорости его горения (υгор). Если соблюдается условие υисп < υгор, то процесс протекает как вспышка – процесс неустойчивого, быстро прекращающегося горения. Если υисп = υгор или υисп > υгор , происходит стабильное или интенсивно развивающееся горение.
Горение паров над жидкостью является турбулентным диффузионным горением.
Для горения жидкостей также существуют пределы воспламенения, но они выражаются температурой.
УСЛОВИЯ ЗАГОРАНИЯ ЖИДКОСТЕЙ В ОТКРЫТОМ ПРОСТРАНСТВЕ
Если жидкость испаряется в открытое пространство, то часть пара все время диффундирует в окружающее пространство. При этом концентрация пара постепенно изменяется по высоте. Непосредственно над поверхностью жидкости она равняется концентрации насыщенного пара, а на большом расстоянии — снижается практически до нуля (кривая 1). Для жидкостей в закрытом пространстве концентрация пара не зависит от расстояния (прямая 2).
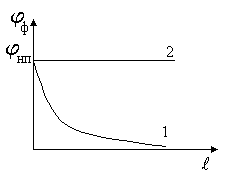
где φф — концентрация пара в заданной точке;
l — расстояние от поверхности жидкости.
Часто бывает необходимо оценить степень пожарной опасности фактической концентрации φ′ф, образовавшейся в производственном помещении при испарении горючей жидкости в открытое пространство. Для этого достаточно разделить массу испарившейся жидкости mисп на объем помещения Vпом:
φ′ф = mисп / Vпом
Для того, чтобы рассчитать площадь разлива, с которой происходит испарение, можно применить соотношение:
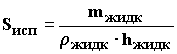
где
mжидк — масса разлившейся при аварии жидкости;
ρжидк — плотность жидкости при заданных условиях;
hжидк — толщина слоя жидкости, разлившейся при аварии.
В практических расчетах, для определения интенсивности испарения жидкости, пользуются эмпирической формулой:
Iисп = Рнп · μ (0,734 + 1,637vв) ·10-6, кг/(м²с)
где
μ — молярная масса вещества кг/кмоль;
Рнп — давление насыщенного пара при данной температуре, кПа.
vв — скорость воздуха над поверхностью испарения, м/с.
В открытой системе, для того, чтобы достичь нижнего концентрационного предела распространения пламени для ненасыщенного пара, жидкость необходимо нагреть до температуры немного вышенижнего температурного пределараспространения пламени, что позволитувеличить интенсивность испарения и компенсировать потери пара за счет диффузии.Еслипри этом к поверхности жидкости поднести источник зажигания, то образовавшийся пар вспыхнет.
Вспышка — быстрое сгорание паровоздушной смеси над поверхностью горючего вещества, которое сопровождается кратковременным видимым свечением. При вспышке стойкое горение не наступает, так как скорость испарения жидкости при данной температуре будет меньше скорости выгорания пара.
Температура вспышки — это наименьшая температура жидкости, при которой в условиях специальных испытаний над ее поверхностью образуется пар, способный вспыхивать в воздухе от источника зажигания, однако стойкое горение при этом не возникает.
Связь температуры вспышки tвсп с зависимостью концентрации пара φпар от температуры жидкости tжидк схематически отображена на рисунке.
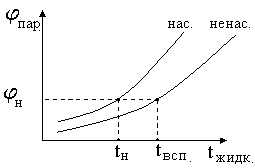
Жидкость, у которой фактическая температура ниже, чем температура вспышки не представляет пожарной опасности в случае кратковременного воздействия источника зажигания.
Температура вспышки принята за основу классификации жидкостей по степени их пожарной опасности. Различают горючие и легковоспламеняющиеся жидкости. К горючим (ГЖ) относят жидкости с температурой вспышки больше 61°С. Жидкости с температурой вспышки 61°С и ниже относят к классу легковоспламеняющихся жидкостей (ЛВЖ). Легковоспламеняющиесяжидкости с температурой вспышки 28°С и ниже относят к особо опасным жидкостям.
Кроме температуры вспышки различают еще температуру зажигания — наименьшую температуру жидкости, при которой после воспламенения пара от источника зажигания устанавливается стационарное горение.
На практике очень часто приходится иметь дело со смесями жидкостей. При оценке степени пожарной опасности смеси, следует иметь в виду, что даже маленькие добавки ЛВЖ к ГЖ могут сильно снизить tвсп смеси.