В основе классификации типов лежит разное распределение электронной плотности между ядрами
| |||
 |


 |


| молекула | связь | Есв, кДж /моль | lсв, нм | вывод |
| F2 | F – F | 159,0 | 0,142 | Чем меньше l св, тем больше Есв и устойчивее молекула |
| H2 | H – H | 436,0 | 0,074 | |
| О2 | О = О | 498,7 | 0,120 | Чем выше кратность* связи, тем больше Есв и устойчивее молекула |
| N2 | N º N | 945,6 | 0,109 |
| Связь | ЕСВ кДж/ моль | l СВ нм | Связь | ЕСВ кДж/моль | l СВ нм | |
| H-F H-Cl H-Br H-I H-H H-S | 0.092 0.128 0.142 0.162 0.074 0.134 | C-C C=C O=O -CºC- CºO NºN | 0.154 0.134 0.121 0.120 0.113 0.110 |


 |
В молекуле Н2О длина связи Н-О равна 0,096 нм, угол связи Н-О-Н – 104,5, а энергия связи Есв = 464 кДж/моль.

Существует несколько квантово-механических подходов к описанию ковалентной связи: метод валентных связей (ВС), метод молекулярных орбиталей (МО)и др..
 |
 |
| ||||
 | ||||
 |
► Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону.
► Донорно-акцепторный механизм - образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Ион аммония NН4+ (NН3 + Н+ ® NН4+)

►Дативные связи – образуются, когда АО, могут выступать одновременно в роли и донора и акцептора неподеленных пар электронов.
 |
Образование молекулы Cl2
Энергия связи в молекуле Сl2 (243 кДж/моль) выше, чем в молекуле F2 (159 кДж/моль), несмотря на большую длину связи.
Молекула NaI
3 s -АО атома Na перекрываются с 5 p – АО атома иода, имеющими по одному неспаренному электрону:
 | |||
| |||
|
Механизм образования связи - обменный.
Валентный угол 180о, структура молекулы - линейная
|
Связь называется - s - связь:
Молекула оксида углерода (II) СО
 |
Между атомами углерода и кислорода образуются 3 связи:
■ две по обменному механизму и
■ одна по донорно-акцепторному механизму:
«O» - донор, «C» - акцептор.
3 ковалентные связи образуются за счет перекрывания 3-х р- АО каждого атома.
Структура молекулы – линейная.

Одна связь - s связь, а две другие - p -связи:
|
Связь называется - p - связь:
Перекрывание АО при образовании p-связей меньше (Есв-меньше), чем при s-связях, поэтому p -связи менее прочные.
Молекула Н2S
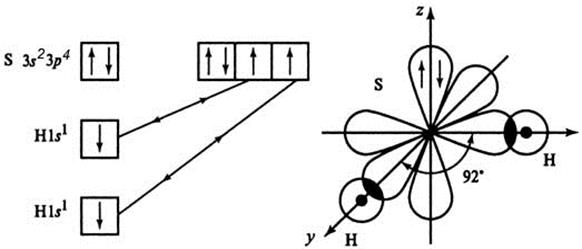
структура – угловая, валентный угол – 92 о
▓ Почему валентный угол в ряду молекул:
H2S (92o), Н2Se (91o) и Н2Те (89о) изменяется?
S, Se и Te - электронные аналоги: S ¼3s23р4
Se ¼4 s 24 p 4
Te ¼5 s 25 p 4
Пространственная конфигурация всех молекул – угловая. Причина изменения валентного угла:
Þ увеличение размера атома;
Þ увеличеие расстояния между связывающими
электронными парами;
Þ уменьшение силы отталкивания между ними;
Þ уменьшение валентного угла.

Молекула НСl:
ЭО(Cl) = 3,0 ЭО(Н) = 2,1
Þ связывающая электронная пара смещена в сторону Cl: Þ эффективный отрицательный заряд (- q) у атома Cl
эффективный положительный заряд (+q) у атома Н
Þ электрический диполь.
|
 |
электрический момент диполя связи m св
|
m св некоторых связей
 |
| молекула | DЭО | m св×10-30,Кл×м | Вывод |
| Н – Сl | 0,90 | 1,03 | Чем больше DЭО, тем больше m св и, следовательно, связь более полярная |
| Н – Br | 0,74 | 0,78 | |
| H - I | 0,40 | 0,38 |
 | |||
|
Электрический момент
диполя молекулы (m м)


