С точки зрения математики, уравнения, в которых в качестве аргумента выступает m, предполагают, что совсем неважно, каким образом формируется то или иное значение m. Например, величину m можно изменять путем уменьшения концентрации углеродного субстрата или азотного субстрата, или путем снижения температуры или повышения величины рН. Для процессов, связанных только с ростом, возможно скорость биосинтеза при этом будет одинакова. Для несвязанных с ростом процессов небезразлично, каким путем мы будем изменять величину m. Лимитирование углеродом, лимитирование азотом, повышение рН или снижение температуры, давая одно и то же значение скорости роста, могут давать совершенно различные скорости биосинтеза продукта метаболизма. Другими словами, связь между qP и m не имеет строго причинно-следственного характера, а обусловлена влиянием на обе эти кинетические характеристики одних и тех же факторов внешней среды. Для таких процессов необходимо использовать уравнения, которые в качестве аргументов содержат независимо влияющие первичные факторы: концентрация того или иного субстрата, температура или величина рН.
Биосинтез продукта может описываться однофакторными или многофакторными уравнениями. Кроме того, было установлено, что структуры зависимостей qP от S, P, температуры и величины рН аналогичны структурам таких же уравнений для роста биомассы, например: Моно, Андрюса, Перта, Хиншельвуда и т.д. Например, если субстрат влияет на qP по Андрюсу, то имеем [10]:
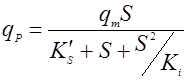 (15),
(15),
где qm – максимальная удельная скорость биосинтеза продукта;
K’S – константа насыщения;
Ki – константа ингибирования продуктом.
Многофакторные зависимости здесь чаще бывают мультипликативными, чем аддитивными. Приведем зависимость мультипликативного [11] и аддитивного влияния концентрации субстрата по механизму Моно:
 (16),
(16),
 (17).
(17).
Применяются также уравнения с не разделяющимися эффектами факторов, например, типа Контуа [10] или неконкурентного торможения продуктом [5]:
 (18),
(18),
 (19).
(19).
К сожалению, невозможно изложить все кинетические зависимости биосинтеза продуктов от первичных факторов в столь короткой работе. Данный материал подробно изложен в монографии [14], в которой приведены не только несколько десятков уравнений, но и произведен их анализ.
Модели, основанные на концепции возраста культуры микроорганизмов.
Для биосинтеза продуктов метаболизма часто бывает недостаточно только благоприятных “внешних” факторов среды. Потому что в биосинтезе участвуют внутриклеточные ферменты микроорганизмов, промежуточные продукты, содержание которых в клетке зависит от предыстории развития культуры. Слишком быстро выросшая культура часто неэффективна с точки зрения биосинтеза продукта. У микробиологов есть выражение “культура ушла в ботву”, что означает биомассы – много, продукта – мало или вообще нет. Однако, учитывать эти внутриклеточные компоненты при моделировании очень проблемно – их трудно измерять и соответственно находить кинетические коэффициенты.
Вместо этого предложены некоторые феноменологические подходы к оценке физиологического состояния микробной биомассы, основанные на оценке возрастного состояния популяции клеток.
Есть несколько подходов для учета возраста культуры. Один из них заключается в определении распределения клеток микроорганизмов по возрастам [12]. Тогда значение удельной скорости биосинтеза продукта можно считать как бы суммой скоростей, даваемых разными возрастными фракциями биомассы:
 (20),
(20),
где ΔXi – концентрация биомассы i-ой возрастной группы;
qi – удельная скорость биосинтеза биомассой i-ой возрастной группы.
При этом, вполне возможно, что значения q1, q2,...,qn не будут одинаковыми: “молодежь” не синтезирует нужный продукт, слишком старые клетки – тоже.
Японским ученым Аибой был предложен более простой подход, использовать для оценки возраста культуры так называемый средний возраст популяции  как параметр, определяющий биосинтетическую активность культуры [13]. Биологически термин вполне понятен – это сумма возрастов всех клеток, деленная на их количество:
как параметр, определяющий биосинтетическую активность культуры [13]. Биологически термин вполне понятен – это сумма возрастов всех клеток, деленная на их количество:
 (21),
(21),
где λi – возраст i-ой возрастной группы.
Если последовательно уменьшать поддиапазоны Δt и ΔΧ, доведя их до бесконечно малых dX и dt, то для среднего возраста можно получить интегральную формулу:
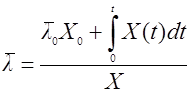 (22),
(22),
где Х0 – начальная концентрация биомассы;
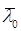 – средний возраст культуры в начальный момент культивирования.
– средний возраст культуры в начальный момент культивирования.
Другим способом упрощения возрастной зависимости является разделение возрастного диапазона клеток на 2 класса – продуктивный (выше некоторого значения) и не продуктивный [14]:
 (24),
(24),
где λ* – возраст зрелости;
qP* – удельная скорость биосинтеза клетки, по достижении ею возраста зрелости.
Теперь остается рассмотреть форму зависимости удельной скорости биосинтеза продукта qР от среднего возраста культуры:  .
.
Если зависимость имеет возрастающий характер с насыщением, то зависимость удобно выразить в форме, похожей на уравнение Моно:
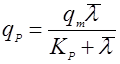 (25).
(25).
Если, наоборот, она падает с возрастом, то лучше подходит выражение, подобное уравнению Иерусалимского:
 (26).
(26).
Если зависимость имеет экстремум, то оно может быть выражена, например, с помощью аппроксимирующего полиномиального уравнения [15]:
 (27).
(27).
Однозначная зависимость между qР и  на практике встречается редко, часто зависимость скорости биосинтеза продукта от возраста учитывают в виде мультипликативного сомножителя, сопряженного с основной частью уравнения, учитывающего влияния остальных факторов.
на практике встречается редко, часто зависимость скорости биосинтеза продукта от возраста учитывают в виде мультипликативного сомножителя, сопряженного с основной частью уравнения, учитывающего влияния остальных факторов.
Модели деградации (инактивации) продуктов метаболизма.
Не всегда синтезированные продукты метаболизма остаются устойчивыми; часто они настолько нестабильны, что разрушаются уже в процессе самой ферментации. Поэтому, описывая материальный баланс по продукту метаболизма, необходимо учитывать кинетику его инактивации:
 (28),
(28),
где  – скорость деградации продукта метаболизма.
– скорость деградации продукта метаболизма.
При рассмотрении синтеза метаболитов, использовалась удельная скорость, в случае деградации, вводить удельную скорость не корректно, т.к. продукт существует отдельно от биомассы, и его деградация не зависит в общем случае от ее концентрации.
Рассмотрим модели кинетики деградации:
 (29),
(29),
деградация отсутствует.
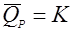 (30),
(30),
деградация идет с постоянной скоростью. Такое выражение странно выглядит в начале процесса, когда продукта еще нет; из уравнения же получается, что концентрация продукта снижается ниже нуля, что не имеет физического смысла.
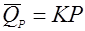 (31),
(31),
реакция разложения первого порядка, пропорционально количеству образовавшегося продукта [16].
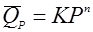 (32),
(32),
реакция разложения n-ого порядка, при чем n может быть как больше 1, так и меньше и не быть целым числом.
 (33),
(33),
реакция разложения зависит не только от концентрации продукта, но и от концентрации биомассы.
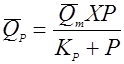 (34),
(34),
скорость реакции разложения зависит от концентрации биомассы и возрастает с концентрацией продукта до какого-то предела.
Приведенные уравнения инактивации (29)-(34) наиболее распространенные, существуют также и другие более сложные зависимости.
Модель накопления продукта метаболизма на примере лейцина.
L-лейцин- незаменимая аминокислота, необходимая для промышленного получения лизина. Производство лизина базируется на лейцинозависимых штаммах. Годовое производство лизина составляет приблизительно 500000 т/г. Лизин широко используется в с/х в качестве кормовой добавки. Лейцин также применяется в спортивном питании, т.к. является предшественником незаменимых жирных кислот, входящих в состав клеточных мембран.
Элементная формула L-лейцина (L-a-аминоизокапроновая кислота): C5H10NH2COOH.
Основным способом производства L-лейцина является микробиологический синтез с использованием штамма Corynebacterium glutamicum. Биосинтез проводился в лабораторном биореакторе. В отбираемых пробах определялась оптическая плотность – Х, содержание лейцина – P и содержание редуцирующих веществ (РВ) по Бертрану – S.
Полученные результаты приводятся в таблице 1.
Таблица 1.

Простейшим предположением о механизме микробиологического биосинтетического процесса является обобщение данных о том, что биосинтез, с одной стороны, ассоциирован с ростом, а с другой, осуществляется покоящейся клеткой.
Поэтому было решено использовать следующее соотношение (8):
 (35),
(35),
где P – концентрация продукта (лейцина), г/л;
aP, bP – эмпирические константы.
aP, bP были определены методом наименьших квадратов: aP=13.27, bP=1.249, сумма квадратов отклонений QP составила 0,884, а средняя квадратичная ошибка SP равна ± 0.6648.

На рис. 3 показаны экспериментальные значения концентрации лейцина и модельные, из рисунка видно, что модель (8) в данном случае достаточно хорошо описывает биосинтез продуктов метаболизма.
Рис. 2. Графическая интерпретация модели биосинтеза лейцина (35).
Список литературы
1. Арзамасцев А.А., Андреев А.А Математические модели кинетики микробного синтеза: возможности использования и новые подходы к разработке // Вестн. Тамб. ун-та. Серия: Естеств. и техн. науки.– 2000.– т.V., № 1– с. 111-130.
2. Renss M. Моделирование и оптимизация процессов // 8th Int. Biotechnol. Symp., Paris– 1988.– vol. 1.– p. 523-536.
3. Zeng An-Ping Кинетическая модель получения продуктов микробных клеток и клеток млекопитающих // Biotechnol. and Bioeng.– 1994.– vol. 45., N 4.– p. 314-324.
4. Vanrolleghem P.A. Структурный подход для выбора среди кандидатов в модель схемы метаболизма и установление неизвестных стехиометрических коэффициентов // Biotechnol. and Bioeng.– 1998.– vol. 2., N 3.– p. 133-138.
5. Перт С.Дж. Основы культивирования микроорганизмов и клеток.– М.: Мир.– 1978.
6. Luedeking R., Piret E.L. A kinetic study of the lactic acid fermentation: Batch process at controlled pH // J. Biochem. Microbiol. Technol. Eng.– 1959.– vol. 1., N 4.– p. 393-412.
7. Осипов Д.С., Гусельникова Т.В. и др. Математическая модель биосинтеза L-лейцина // Труды МГУИЭ.– 2001.– т.V.– с. 19-23.
8. Mori A., Terui G. Kinetic studies on submerged acetic acid fermentation: Inhibition by ethanol // J. Ferment. Technol.– 1972.– vol. 50, N 11.– p. 776-786.
9. Музыченко Л.А., Валуев В.И. Использование полунепрерывного культивирования микроорганизмов для получения продуктов биосинтеза // В кн.: Теория и практика непрерывного культивирования микроорганизмов.– Красноярск.– 1978.– с. 112-113.
10. Bajpai R.K., Reuss M. A mechanistic model for penicillin production // J. Chem. Technol. and Biotechnol.– 1980.– vol. 30,– p. 332-344.
11. Баснакьян И.А., Бирюков В.В., Крылов Ю.М. Математическое описание основных кинетических закономерностей процесса культивирования микроорганизмов // В кн.: Итоги науки и техники. Микробиология. Т. 5. Управляемое и непрерывное культивирование микроорганизмов.– М. – 1976.– с. 5-75.
12. Shu P. Mathematical model for product accumulation in microbiological processes // J. Biochem. Microbiol. Technol. Eng.– 1961.– vol. 3, N 1,– p. 95-109.
13. Aiba S., Hara M. Conception of average cumulative age of microorganisms // J. Gen. and Appl. Microbiol.– 1965.– vol. 11,– p. 25-41.
14. Бирюков В.В., Кантере В.М. Оптимизация периодических процессов микробиологического синтеза.– М.: Наука.– 1985.
15. Фишман В.М. Математическое описание и оптимальное управление процессом биосинтеза антибиотиков // Дис. канд. техн. наук.– М.: Московский институт химического машиностроения– 1970.
16. Ettler P., Votruba J. Determination of the optimal feeding regime during biosynthesis of erythromycin // Folia microbiol.– 1980.– vol. 25,– p. 424-429.