I. Реакции присоединения.
Гидрирование (взаимодействие с водородом)
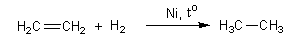
этилен этан
При гидрировании алкены превращаются в алканы.
Галогенирование (взаимодействие с галогенами)
Непредельные соединения быстро обесцвечивают раствор брома в воде – бромную воду. Это – качественная реакция на кратные связи.
| бесцветный |
| бурого цвета |
| 1,2-дибромэтан |
| этилен |

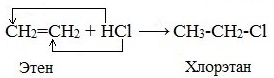
Гидрогалогенирование (взаимодействие с галогеноводородами)
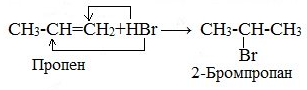
По правилу Марковникова:
Атом водорода присоединяется к тому атому углерода двойной связи, у которого больше атомов водорода.

| Н+ |
СН2 = СН2 + НОН → СН2-СН2
ǀ ǀ
| этилен |
| этиловый спирт |
Присоединение воды к несимметричным алкенам идет по правилу Марковникова.

Образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, содержащихся в газах крекинга нефти (попутных газов), а также в коксовых газах.
5. Реакции полимеризации — процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера).
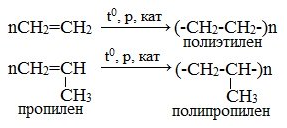
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
II. Реакции окисления. Алкены легко окисляются.
Горение.
СН2=СН2 + 3О2 → 2СО2 + 2Н2О
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
2. Неполное каталитическое окисление.
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 2000С серебряным катализатором, то образуется оксид алкена (эпоксид). Циклические оксиды широко используются в органическом синтезе.
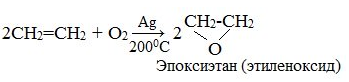
3. Окисление раствором КМnO4 в нейтральной или щелочной среде (реакция Вагнера) - качественная реакция.
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов.
| бесцветный |
| розовый |

или упрощенно

В результате этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4 и выпадает коричневый осадок оксида марганца (IV).
Окисление перманганатом калия в кислой среде.
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи с образованием:
а) карбоновых кислот;
б) кетонов (если атом углерода при двойной связи содержит два заместителя);
в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):

Изомеризация алкенов.
Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит или к перемещению π–связи:

или к перестройке углеродного скелета:

Получение алкенов.
- Промышленные способы.
В природе алкены встречаются в меньшей степени, чем предельные углеводороды, вследствие своей высокой реакционной способности. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, поэтому их получают с использованием различных реакций.
Крекинг алканов, входящих в состав нефти и попутного газа.
C8H18 → C 4 H 8 + C4H10 (400-700 oС)
октан бутен бутан
| Cr2O3, t |
C4H10 → C4H8 + H2
бутан бутен водород
3. Гидрирование алкинов (присоединение молекул водорода).
| Ni, Pt |
СН3-С≡С-СН3 + Н2 → СН3-СН=СН-СН3
· Лабораторные способы.
Алкены получают по реакциям отщепления (элиминирования) двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи.
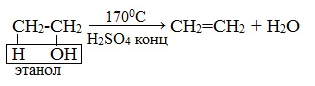
1. Дегидратация спиртов (отщепление молекул воды) (при t в присутствии концентрированной H2SO4).
Этилен получают при нагревании этилового спирта в присутствии концентрированной серной кислоты, как сильного водоотнимающего вещества при нагревании и недостатке спирта:
2. Дегидрогалогенирование моногалогеналканов действием спиртового раствора щелочи (происходит по правилу Зайцева).
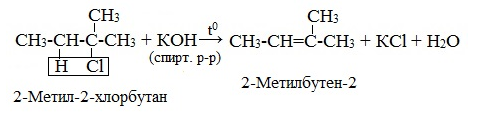
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов (Mg, Zn).

Применение алкенов.
Этилен
1. В качестве мономера при получении полиэтилена.
2. Для производства ацетальдегида и синтетического этилового спирта.
3. Для дозревания фруктов (ри введении небольших количеств его в воздух теплиц).
4. В производстве охлаждающих жидкостей и теплоносителей.
Пропилен в промышленности применяется, в основном, для синтеза полипропилена. Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
Полипропилен по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Волокно из полипропилена прочнее всех известных синтетических волокон.
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10;С18 применяют при синтезе ПАВ, а также для получения высших спиртов.