Химическое равновесие. Обратимые и необратимые по равновесию реакции. Термодинамические условия равновесия. Константы химического равновесия. Прогнозирование смещения химического равновесия.
Химическое равновесие -состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем(А2 + В2 ⇄ 2AB)
 ₁=
₁=  ₂ - кинетическое условие равновесия
₂ - кинетическое условие равновесия
ΔG=0, ΔS=0,  пр.=
пр.= 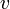 обр – термодинамическое условие равновесия (Не зависит от концентрации, а зависит от температуры и природы реаг. в-в.)
обр – термодинамическое условие равновесия (Не зависит от концентрации, а зависит от температуры и природы реаг. в-в.)
(Δ G – энергия Гиббса = ΔH - TΔS)
Обратимые хим.реакции -реакции, кот. при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлениях. Обратимость по направлению не тождественна с термодинамической обратимостью процесса. (ΔG 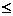 10 кДж/моль)
10 кДж/моль)
Необратимые хим.реакции- реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.(ΔG 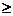 10 кДж/моль)! реакции, необратимые в данных условиях, с изменением их могут стать обратимыми.
10 кДж/моль)! реакции, необратимые в данных условиях, с изменением их могут стать обратимыми.
Константы химического равновесия
A+B ⇌ N+M
Скорость прямой реакции (обратимой): w₁= k₁* [A] [B] (1)
Cкорость обратной химический реакции: w₂=k₂* [N][M] (2)
Концентрации веществ, а в случае реальных р-ров активность (моль/л), фугитивность (Па) в случае реальных газов, должны быть взяты в ст. их стехиометрических коэффициентов.
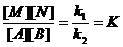
Константа равновесия(K) – постоянная величина-частное от деления константы скорости хим. реакции k₁ на константу скорости обратной реакции k₂. Если в уравнении для константы равновесия обратимой газовой реакции действующие массы всех реагентов представляют собой концентрации, выраженные в моль/л, то обозначается Кс, если же эти действующие массы заданы как соответствующие парциальные давления газов, то – Кр.
Равенства (1 и 2) следуют из закона действующих масс, они корректны лишь при опр. условиях. Предполагается, что средние расстояния между молекулами/ионами реагентов столь велики, что силовое взаимодействие м/у ними не отражается на их беспорядочном движении (идеальные р-ры/газы, реальные газы приближаются к идеальных посредством понижения давления, растворы – по мере разбавления). Уравнение скоростей корректно лишь для одностадийных реакций, уравнение константы справедливо и для многостадийных реакций.
Численные значения константы равновесия зависят от: 1) природы реагентов, 2) температуры, 3) в случае обратимых реакций, сопровождающихся изменением V реагирующей системы - от давления. Не зависят от: 1) концентрации (активности), 2)парциальных давлений (фугитивностей).
Прогнозирование смещения химического равновесия.
Смещение ХРавн-я – изменение равновесных концентраций реаг. в-в и прод-в, вызванное к-либо воздействиями. Оно подчиняется принципу Ле Шателье-Брауна: «Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в рез-те протекающих в ней процессов равновесие сместится в таком направлении, чтобы оказанный эффект был ослаблен.»
Факторы, влияющие на хим. равновесие:
1) Температура - при увеличении температуры ХРавн-е смещается в сторону эндотерм. р-ции, а при понижении – в сторону экзотермической.
2) Давление - при увеличении давления ХРавн-е смещается в сторону меньшего объема в-в, а при понижении – в сторону большего объема (только для газов)
3) Концентрация – при повышении концентрации одного из исходных в-в ХР смещается в сторону продуктов реакции, а при увеличении концентрации продуктов – в сторону исходных в-в.
4) Катализаторы не влияют на смещение ХРавн-я.
Условия протекания обратимых хим. реакций до конца:
1. Выпадает осадок
2. Выделяется труднорастворимый газ
3. Обр. слабый электролит (например вода, хлорид ртути)
4. Обр. устойчивый комплексный ион или нейтральное комплексное соединение
5. Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучениея скоростей и механизмов биохимических процессов. Скорость химической реакции. Классификация реакций, применяющиеся в кинетике: реакции гомогенные, гетерогенные; реакции простые и сложные. Молекулярность реакции. Кинетические уравнения. Порядок реакции. Период полупревращения.
Хим. кинетика - раздел физ. химии, изучающий скорость и механизмы хим. реакций. Знание хим. К. повзоляет упр-ть ХР, регулировать их скорость. Можно ускорить ХР и тем самым увеличить выход продукта или замедлить.
Скорость явл. важнейщей хар-кой хим. превращений. Скорость 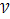 - изменение концентрации одного из реагирующих веществ в ед. времени.
- изменение концентрации одного из реагирующих веществ в ед. времени.
Δс= с₂-с₁ 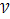 =
= 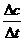
Δt=t₂-t₁ В ходе реакции идет убыль конц. исх. в-в и увеличение конц. продуктов реакции.
Скорость является функцией от времени: 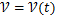 , тк скорость превращения может меняться в ходе реакции.
, тк скорость превращения может меняться в ходе реакции.
Скорость химической реакции зависит от:
1)природы веществ (экстенсивный ф-р-звисит от массы в-ва) закон Менделеева: свойства элементов и их соед. находятся в период. зависимости от зарядов их атомов;
2)от концентрации (экстенсивный ф-р) закон действующих масс (К.М.Гульберг, П.Вааге): «при постоянной температуре 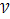 хим. реакции прямо пропорциональна действ. массам – молярным конц. реаг. в-в, взятым в степени соотв. стехиометричеких коэффициентов»
хим. реакции прямо пропорциональна действ. массам – молярным конц. реаг. в-в, взятым в степени соотв. стехиометричеких коэффициентов»
Чем больше конц.реагентов, тем больше % активных соударений молекул.
3)температуры (интенсивный ф-р-число участников не изменяется, меняется их E) правило Вант-Гоффа.
4)от присутствия катализаторов и ингибиторов,
Kat-инт.в-во, кот. в ничтожно малых кол-вах резко ускоряет реакцию.
Ing- в-во, замедляющее или предотвращающее течение какой-либо химической реакции.
Катализ бывает гомогенным (kat в той же фазе, что и взаимод.в-ва), гетерогенным (дает чистый продукт)
5)для вещества в твердом состоянии – от поверхности реагирующих веществ.
6) для в-ва в газообразном состоянии – от давления, из уравнения Менделеева-Клайперонаследует, что изменение каждого из компонентов газовой смеси должно оказывать на скорость газовой реакции то же влияние, что и пропорц. ему изм-ие этого же компонента.(p= cRT)
Классификация хим.реакций
1) по механизму:
-простые- осуществляется посредством однотипных элементарных актов (взаимодействий или превращений частиц, в рез-те которого обр. новые частицы продуктов реакции или промежуточные продукты);
-сложные- те, которые состоят из нес-ких стадий, порядок реакции не совпадает с её молекулярностью.
2)по агрегатному состоянию:
-гомогенные-все исходные вещ-ва в одной фазе, реакция идет по всему объему смеси -гетерогенные- исх. вещ-ва в разных фазах, важна площадь соприкосновения реагирующих вещ-в.
Молекулярность- число молекул, одновременным взаимодействием которых осуществляется элементарный акт хим. реакции (характеризуется только целыми числами).
Мономолекулярные р-ции-разложения (или изомеризации), бимолекулярные- осуществляются при столкновении 2 молекул; тримолекулярные; тетрамолекулярные.
Если выражение закона действующих масс для данной реакции известно, функц. зависимость концентр. участвующих в реакции в-в. от времени с(t) мб получена в аналитическом виде. Соответствующая функц. зависимость называется уравнением кинетики.
Порядок реакции- число, равное сумме показателей степеней конц. реагирующих веществ в уравнении для 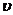 реакции (кинетическом).
реакции (кинетическом).
В виде случайного совпадения молекулярность может совпадать с порядком (для простых одностадийных реакций). Порядок реакции характеризует кинетическую зависимость скорости реакции от конц. реаг. в-в.
Период полупревращения- - это время, необходимое для того, чтобы исходная концентрация реагента уменьшилась вдвое. Измерение периода полупревращения приносит большую пользу при исследованиях порядка реакции. Например, в реакциях первого порядка период полупревращения 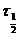 связан с константой скорости к простым соотношением:
связан с константой скорости к простым соотношением: 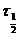 = 0,693/k.
= 0,693/k.
Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков.
Закон действующих масс (К.М.Гульберг, П.Вааге): «при постоянной температуре  хим. реакции прямо пропорциональна действ. массам – молярным конц. реаг. в-в, взятым в степени соотв. стехиометричеких коэффициентов»
хим. реакции прямо пропорциональна действ. массам – молярным конц. реаг. в-в, взятым в степени соотв. стехиометричеких коэффициентов»
Чем больше конц.реагентов, тем больше % активных соударений молекул.
aA+bB ⇌mM + nN
скорость прямой реакции: w₁=k₁*[A]a [B]b ,
скорость обратной реакции w₂=k₂*[M]m [N]n
примеры реакций, для которых k₁>>k₂ и w₁>>w₂ - обменные в р-рах,
примеры реакций, для которых k₂>k₁ и w₁>w₂ - гидролиз, заканчивающийся не полным превращением исх. соли в конечные продукты.
Чем больше ст.дробления (площадь контакта), тем выше 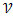 реакции.
реакции.
Порядок реакции- число, равное сумме показателей степеней конц.реагирующих в-в в кинетическом уравнении.
Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль хим.реакции: Eакт, уравнение Аррениуса.
Правило Вант-Гоффа: при повышении T реакции системы на каждые 10 C, скорость реакции увеличивается в 2-4 раза:
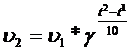 ;
; 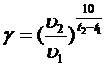
Для каждой реакции коэффициент свой (от 2 до 4).
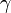 in vitro = 2-4 («в стекле»),
in vitro = 2-4 («в стекле»),
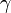 in vivo = 7-9 («в теле»)
in vivo = 7-9 («в теле»)
4)от присутствия катализаторов и ингибиторов,
Kat-инт.в-во, кот. в ничтожно малых кол-вах резко ускоряет реакцию.
С точки зрения закона действующих масс изменение скорости обусловлено температурной зависимости константы скорости.
Типы температурной зависимости:
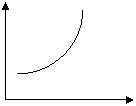
1) нормальный – возрастает скорость с увеличением t (характерна для простых реакций)
 |
2) аномальный – падение скорости с увеличением t (газофазная реакция азота (II) оксида с бромом)
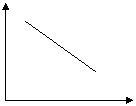 |
3) ферментативный – реакции с участием ферментов. (почти все реакции, протек. в организме).
 |
Ферменты-большие молекулы белковой природы,
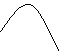 обладающие 1) высокой специфичностью,
обладающие 1) высокой специфичностью,
2)проявлением каталитической акт.в довольно
мягких условиях T,p,кислотности среды.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
1. Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
2. Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
3. Молекулы должны быть правильно ориентированы относительно друг друга.
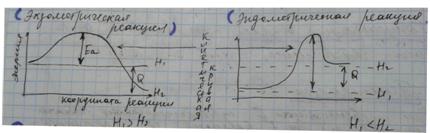
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
Энергия активации (Ea) — та минимальная энергии, которую необходимо сообщить 1 моль в-ва, чтобы все молекулы в нем стали активными.
Уравнение Аррениуса: это уравнение связывает константу скорости. 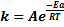
Eа, A– постоянные, не зависящие от t. Величина А - предэкспоненциальный коэф-т,указывающий долю числа столкновений м/у молекулами, оканчивающими реакцию.; R – универсальная газовая постоянная=8,314 Дж/моль*К; T – абсолютная температура.
 N – общее число молекул в системе. А - число активных молекул, кот-ые при данной t облад. энергией активации
N – общее число молекул в системе. А - число активных молекул, кот-ые при данной t облад. энергией активации

Энергия активации в реакциях = 0, => скорость мгновенна
Энергия активации в эндо- и экзо- реакциях неодинакова