Пояснительная записка
Физическая и коллоидная химия завершает общехимическую подготовку учащихся и вместе с другими дисциплинами является теоретической основой технологических дисциплин.
Программой предмета "Физическая и коллоидная химия" предусматривается изучение теоретических основ курса, выполнение лабораторных работ, выполнение контрольной домашней работы.
Дисциплина изучается в тесной связи с такими дисциплинами, как «Аналитическая химия», «Основы технологии пищевых производств», «Стандартизация и контроль качества продукции пищевых производств».
Основной формой занятий учащегося-заочника является самостоятельная работа с книгой.
Для глубокого, осознанного усвоения программного материала, необходимо составлять конспект, который будет полезен для повторения курса при подготовке к экзамену. В конспект следует включать формулировки основных понятий, законов, определения основных терминов, схемы, формулы.
К выполнению контрольных заданий следует приступать только после изучения соответствующих разделов программ и овладения основными приемами решения задач.
Изучение курса следует вести в полном соответствии с программой в следующем порядке:
- Ознакомится с программой и методическими указаниями по данной теме. В методических указаниях даётся разъяснение наиболее важных и трудоёмких разделов темы.
- Изучить по учебнику материал, относящийся к данной теме.
- В рабочей тетради составить конспект по изучаемому материалу.
Завершающим этапом самостоятельного изучения предмета является выполнение домашней контрольной работы. Номер варианта выбирается по последним двум цифрам шифра.
- Ответы на вопросы контрольной должны быть краткими, обоснованными, исчерпывающими.
- При решении задач обязательно записывать условие задачи сначала полное, затем краткое и затем дать полный ход решения задачи.
- Прежде чем дать ответ на вопрос, надо написать содержание вопроса.
- В конце работы необходимо указать список используемой литературы, указать дату выполнения работы и поставить подпись.
- Выполненная контрольная работа направляется в техникум на проверку.
- Получив проверенную работу, учащийся должен исправить отмеченные ошибки и выполнить все указания преподавателя.
- Если работа выполнена неудовлетворительно или не соответствует своему варианту, она возвращается учащемуся незачтённой.
Лабораторные работы выполняются в лаборатории колледжа после изучения теоретических вопросов по каждой теме. По каждой лабораторной работе проводятся записи в лабораторном журнале. По окончании выполнения лабораторных работ учащиеся сдают зачёт. Без сдачи зачёта они не допускаются к экзаменам.
В результате изучения предмета
Учащиеся должны знать:
- законы физической и коллоидной химии
- процессы, основанные на законах физической и коллоидной химии
- дисперсные системы и их особенности
- свойства растворов высокомолекулярных соединений и их значение в пищевой технологии
Учащиеся должны уметь:
- применять теоретические знания для понимания свойств пищевого сырья, технологии его переработки, оценки качества готовой продукции
- характеризовать технологические процессы
- анализировать условия для разработки мероприятий по охране окружающей среды
- пользоваться приборами и оборудованием
- производить расчеты, используя формулы и законы физической и коллоидной химии
Тематическое планирование
| Учебные темы | Количество часов | |||||
| Для дневной формы | Для заочной формы | |||||
| Всего | В том числе | Всего | В том числе | |||
| Теоретич. | Лабор.-практ. | Обзорные | Лабор.-практ | |||
| Введение. | - | - | - | - | ||
| Раздел 1.Физическая химия. | - | |||||
| 1.1. Агрегатные состояния веществ. | - | - | - | |||
| 1.2. Основы химической термодинамики. Термохимия. | - | - | - | - | ||
| 1.3. Фазовые равновесия. Растворы. | - | - | ||||
| 1.4. Основы химической кинетики и катализа. | - | |||||
| Обязательная контрольная работа | - | - | - | - | ||
| Раздел 2. Коллоидная химия. | ||||||
| 2.1. Поверхностные явления. Адсорбция. | ||||||
| 2.2. Коллоидные системы Тематическая контрольная работа № 1. | ||||||
| 2.3. Грубодисперсные системы. Тематическая контрольная работа № 2. | - | |||||
| 2.4. Высокомолекулярные соединения и их растворы. | - | |||||
| ИТОГО: |
Методические рекомендации по изучению разделов, тем программы
Раздел 1. Агрегатные состояния вещества
Общая характеристика газообразного, жидкого и твердого состояний веществ.
Жидкое состояние вещества. Внутреннее давление, поверхностная энергия и поверхностное натяжение. Вязкость. Уравнение Ньютона и Пуазейля. Методы определения вязкости.
Твердое состояние вещества. Кристаллические и аморфные тела, их характеристика.
Литература
[1] гл. 1 § 1-7.
Методические рекомендации
Обратите внимание на основные характеристики газообразного, жидкого и твердого состояния веществ. Уясните сущность вязкости, поверхностного натяжения и возможности их расчетов по формулам и практическому определению.
Раздел 2. Основы химической термодинамики
I начало термодинамики. Внутренняя энергия. Энтальпия. Термохимия. Закон Гесса. Теплота образования и горения. Вычисление тепловых эффектов химических реакций.
II начало термодинамики. Энтропия. Факторы, определяющие направленность химических реакций. Условия самопроизвольного течения процессов.
Литература
[1] гл. 2 § 1-7.
Раздел 3. Растворы
Общая характеристика. Растворы газов в жидкостях, твердых тел в жидкостях, жидкостей в жидкостях. Закон Генри. Влияние t°, р, концентрации на растворимость веществ. Взаимная растворимость жидкостей. Экстракция. Растворимость твердых тел в жидкостях. Теплота растворения. Диффузия и осмос, осмотическое давление, их сущность и значение. Закон Рауля. Криоскопия и эбуллиоскопия. Температура замерзания и кипения растворов.
Литература
[1] гл. 3 § 4, 5, 8-12.
Методические рекомендации
Уясните, что диффузия – это двусторонний процесс распределения веществ, а осмос – односторонний процесс проникновения молекул растворителя через полупроницаемую мембрану. Объединяет эти процессы тот факт, что в результате этих процессов происходит выравнивание концентраций веществ.
Четко усвойте методику расчета осмотического давления, температуру замерзания, кипения растворов и причину отличия их у растворителей и растворов.
При решении задач обращайте внимание на «ключевое слово» в условии, что поможет выбрать верную формулу для решения.
Задача 1.
Рассчитайте осмотическое давление раствора глюкозы, если 200 г ее растворили в мерной колбе при t = 25°С объемом 500 мл.
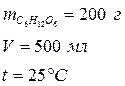 Дано: Решение:
Дано: Решение:
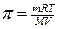
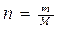
 «Ключевое слово» – осмотическое давление по-зволяет верно выбрать для решения формулу Вант-Гоффа:
«Ключевое слово» – осмотическое давление по-зволяет верно выбрать для решения формулу Вант-Гоффа:
πv = nRT,, т. е.;
 |
 При решении необходимо соблюдать размерность величин в системе Си.
При решении необходимо соблюдать размерность величин в системе Си.
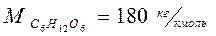 |

Задача 2.
Рассчитайте tкип. и tзам. 10% раствора сахарозы.
(Кэб. = 0,516°С; Ккр. = 1,86°С).
 |
 Дано: Решение:
Дано: Решение:
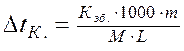

 «Ключевые слова» – температура кипения и температура замерзания предполагают использование формулы:
«Ключевые слова» – температура кипения и температура замерзания предполагают использование формулы:
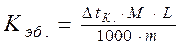 |
, откуда
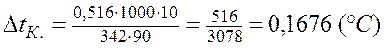 т. к. раствор 10%, то m = 10 г, а L = 100-
т. к. раствор 10%, то m = 10 г, а L = 100-
-10=90 г.
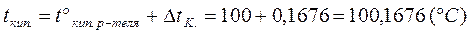 |
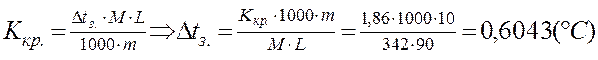 |
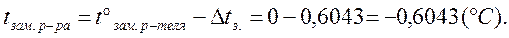 |
Задача 3. Вычислить давление пара 5 %-ного водного раствора сахарозы при t = 50° С. Давление паров воды при этой температуре равно 92,51 мм рт. ст.
 Дано: Решение:
Дано: Решение:
ωсахар. = 5 % «Ключевые слова» - давление паров говорят о необходимос-
t = 50° C ти для решения задачи использовать Формулу Рауля:
 ρо = 92, 51 мм рт. ст.
ρо = 92, 51 мм рт. ст. 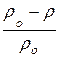 = N, где
= N, где
ρ -? ρо – давление паров воды;
ρ – давление паров раствора;
N – мольная доля растворенного вещества.
Так как ω = 5 %, то mсахар. = 5 г, mH 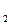 O = 100 – 5 = 95 г
O = 100 – 5 = 95 г
N = 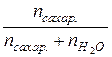 ; при nсахар.<< nH
; при nсахар.<< nH 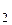 O N =
O N = 
М(сахар) = 342 г/моль; n(cахар) = 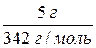 = 0,015 (моль)
= 0,015 (моль)
М(H 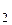 O) = 18 г/моль; n(H
O) = 18 г/моль; n(H 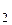 O) =
O) = 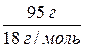 = 5,278 (моль)
= 5,278 (моль)
N = 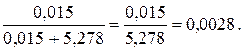
В СИ давление выражается в Па, поэтому ρо = 92,51 мм рт. ст. = 12,3 · 103 Па, поэтому ρ = ρо(1 - N) = 12,3 · 103(1 – 0,0028) = 12,26 · 103 Па.
Задача 4. При температуре 20° С давление пара воды равно 2,314 · 103 Па. На сколько понизится давление пара при этой температуре, если в 1 литре воды растворить 50 г сахарозы?
 Дано: Решение:
Дано: Решение:
t = 20° C Из формулы Рауля:
ρо = 2,314 · 103 Па ρo – ρ = ∆ρ, поэтому 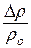 = N;
= N;
VH 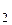 O = 1 л N =
O = 1 л N = 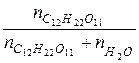 ;
;
 mC
mC  H
H 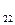 O
O 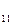 = 50 г nC
= 50 г nC  H
H 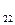 O
O 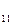 =
= 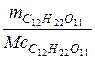 =
= 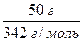 = 0,146 моль;
= 0,146 моль;
∆ρ -? mH  O = VH
O = VH  O · ρH
O · ρH  O = 1000 см3 · 1 г/см3 = 1000 г;
O = 1000 см3 · 1 г/см3 = 1000 г;
nH 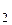 O =
O = 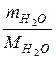 =
= 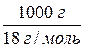 = 55,56 моль;
= 55,56 моль;
N = 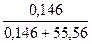 = 0,0026;
= 0,0026;
∆ρ = 2,314 · 103 · 0,0026 = 6,016 Па.
Задача 5. Раствор, содержащий 4,5 г вещества в 50 г воды, кипит при температуре 100,26° С. Определить молярную массу растворенного вещества (Кэб = 0,52°).
 Дано: Решение:
Дано: Решение:
Кэб = 0,52 Кэб = 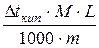 , значит М =
, значит М = 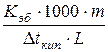 ;
;
m = 4,5 г ∆tкип = tкип. р-ра - tкип. р-ля;
tкип = 100,26° С ∆tкип = 100,26° - 100 = 0,26°;
 М -? М =
М -? М = 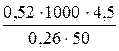 = 180 (г/моль).
= 180 (г/моль).
Задача 6. Определить массу глюкозы, содержащейся в 5 л раствора при 25°С, если осмотическое давление такого раствора составляет 4,82 ат.
 Дано: Решение:
Дано: Решение:
V = 5 л На основании формулы Вант- Гоффа:
t = 25° C π = 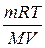 , можем записать
, можем записать
 π = 4,28 ат m =
π = 4,28 ат m = 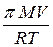 .
.
m -? Подставляем все величины в системе СИ:
π – в Па, V – в м3, температуру – в К.
m = 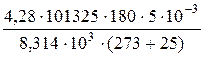 = 1,8 · 10-3 кг.
= 1,8 · 10-3 кг.
Задача 7. Рассчитать малярную массу неэлектролита, водный раствор которого, содержащий 0,730 г неэлектролита в 400 мл раствора при 20° С, имеет осмотическое давление 73967 Па.
 |
Дано: Решение:
m = 0,730 г На основании формулы Вант-Гоффа:
V = 400 мл М = 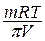 .
.
t = 20° C Приводим все величины в СИ:
π = 73967 Па m = 0,73 · 10-3 кг
 М -? V = 4 · 10-4 м3
М -? V = 4 · 10-4 м3
Т = 273 + 20 = 293 К
М = 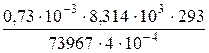 = 60 (кг/кмоль).
= 60 (кг/кмоль).
Раздел 4. Химическая кинетика. Катализ
Скорость химической реакции. Зависимость скорости реакции от различных факторов. Константа скорости. Активные молекулы. Энергия активации.
Фотохимические реакции. Закон эквивалентности Эйнштейна. Квантовый выход. Цепные реакции. Катализ и его виды. Ингибиторы. Автокатализ. Ферментативный катализ. Применение катализа в пищевой промышленности.
Литература.
[1] гл. 4 § 1-14.
Раздел 5. Адсорбция.
Значение адсорбционных процессов для пищевых технологий. Адсорбция, ее виды. Адсорбционное равновесие. Влияние различных факторов на адсорбцию. Изотерма адсорбции. Адсорбция на границе твердое тело – газ. Уравнение изотермы адсорбции Фрейндлиха. Уравнение Ленгмюра. Основные положения теории мономолекулярной адсорбции. Адсорбция паров на пористом адсорбенте. Капиллярная конденсация. Адсорбция на границе твердое тело – раствор, ее разновидности. Особенности избирательной адсорбции. Правило Фаянса-Пескова. Ионообменная адсорбция, ее сущность, значение. Адсорбция на границе жидкость – газ, жидкость – жидкость. Поверхностно-активные вещества. Дифильность молекул. Строение адсорбционного слоя. Уравнение изотермы адсорбции Гиббса. Правило Траубе. Смачивание. Гидрофилизация и гидрофобизация. Адсорбционное понижение твердости (эффект Ребиндера).
Литература.
[1] гл. 6 § 1-11.
Раздел 6. Дисперсные системы. Коллоидные системы.
Классификация дисперсных систем. Дисперсность. Удельная поверхность. Коллоидные системы, их особенности. Получение коллоидных систем. Стабилизация. Очистка коллоидных систем.
Оптические свойства коллоидных систем. Опалесценция. Уравнение Релея. Ультрамикроскопия.
Молекулярно-кинетические свойства коллоидных систем. Броуновское движение, его природа. Средний сдвиг. Уравнение Эйнштейна-Смолуховского. Особенности диффузии и осмотического давления в коллоидных системах. Кинетическая и агрегативная устойчивость коллоидных систем. Электрокинетические явления в золях. Строение двойного электрического слоя. Электрокинетический потенциал. Строение мицеллы гидрозоля.
Рекомендации.
Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. В гидрозолях дисперсионной средой является вода, а дисперсионной фазой – мицеллы. Система устойчива в присутствии ионного стабилизатора.
В реакциях ионного обмена ионным стабилизатором является вещество, которое взято в избытке, а в реакциях гидролиза – вещество, полученное при взаимодействии продуктов реакции. Основной частью мицеллы является ядро (1). Роль ядра играет вещество при обычных условиях практически нерастворимое. На ядре адсорбируются потенциалопределяющие ионы (2) и часть противоионов (3). Ядро вместе с адсорбционным слоем потенциалопределяющих ионов и противоионами адсорбционного слоя образуют гранулу. Ее заряд зависит от заряда потенциал определяющих ионов. Оставшаяся часть противоионов (4) находится в диффузном слое. При выборе потенциалопределяющих ионов руководствуются правилом Пескова.
Например:
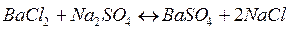 |
1. Записать строение мицеллы, полученной при действии на хлорид бария избытком сульфата натрия. Укажите составные части мицеллы.
изб.
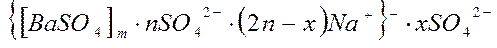 |
ионный стабилизатор – Na2SO4.
 |  | ||
1 2 3 4
 |
2. Записать строение мицеллы, полученной при полном гидролизе железа (III).
 ионный стабилизатор – FeOCl.
ионный стабилизатор – FeOCl.
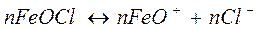 |
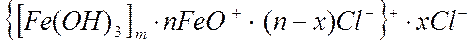 | |||||||||||||
 |  |  |  |  |  | ||||||||
1 2 3 4
 |
1 – ядро
2 – потенциалопределяющие ионы
3 – противоионы адсорбционного слоя
4 – противоионы диффузного слоя
5 – гранула
3. Какова формула и схема строения мицеллы, полученной при действии по каплям раствора кальций нитрата на раствор натрий фосфата?
Уравнение реакции:
 3Са(NO3)2 + 2Na3PO4 Ca3(PO4)2 + 6NaNO3
3Са(NO3)2 + 2Na3PO4 Ca3(PO4)2 + 6NaNO3
Избыток является ионным стабилизатором:
 nNa3PO4 3nNa+ + nPO43-
nNa3PO4 3nNa+ + nPO43-
Ядро – практически нерастворимое вещество: Ca3(PO4)2
Формула мицеллы: {[Ca3(PO4)2]m · nPO43-(3n – x)Na+}ˉxNa+
Схема строения:

4. Какова формула мицеллы золя Ag, стабилизированной AgNO3?
Ядро – Ag
Стабилизатор – AgNO3
 nAgNO3 nAg+ + nNO3ˉ
nAgNO3 nAg+ + nNO3ˉ
Формула мицеллы:
[(Ag)m · nAg+(n - x)NO3ˉ]+ xNO3ˉ
Коагуляция золей электролитами. Нейтрализационная и концентрационная коагуляция. Правило Шульца-Гарди Изоэлектрическое состояние. Порог коагуляции.
Коагуляция золей электролита подчиняется правилу Шульце- Гарди, содержание которого можно выразить так:
- коагулирующее действие оказывают лишь те ионы добавляемого электролита, которые имеют знак заряда, противоположный заряду гранулы;
- действие ионов-коагулянтов во много раз усиливается с повышением их заряда.
Например, если коагулирующее действие катиона натрия принять за единицу, то в соотношении катионов Na+, Ca2+, Al3+ можно сделать следующее сопоставление:
Коагулирующие ионы: Na+ Ca2+ Al3+
Заряд катионов: 1+ 2+ 3+
Коагулирующее действие: 1 78 543
Пример 1. Какой из электролитов: CuCl2, Na2SO4, KCl является лучшим коагулятором для мицеллы золя с положительным зарядом гранулы?
Коагуляцию золя с положительным зарядом гранулы согласно правила Шульце-Гарди будут вызывать отрицательные ионы (анионы):
 CuCl2 Cu2+ + 2Clˉ
CuCl2 Cu2+ + 2Clˉ
 Na2SO4 2Na+ + SO42-
Na2SO4 2Na+ + SO42-
 KCl K+ + Clˉ
KCl K+ + Clˉ
Так как заряд аниона SO42- больше заряда ионов Clˉ, то лучшим коагулятором является электролит Na2SO4.
Пример 2. Какой из электролитов Fe2(SO4)3 или K3PO4 быстрее вызовет коагуляцию золя с отрицательным зарядом гранулы?
 Fe2(SO4)3 2Fe3+ + 3SO42-
Fe2(SO4)3 2Fe3+ + 3SO42-
 K3PO4 3K+ + PO43-
K3PO4 3K+ + PO43-
Согласно правила Шульце-Гарди, быстрее вызовет коагуляцию железо (III) сульфат Fe2(SO4)3.
Литература.
[1] гл. 7 § 1-8, гл. 8 § 1-5.
Структурообразование в дисперсных системах.
Свободнодисперсные системы. Вязкость свободнодисперсных систем. Коагуляционные структуры. Гелеобразование и пептизация. Синерезис. Тиксотропия. Вязкость связнодисперсных систем. Уравнение Шведова-Бингама. Предел текучести. Реологические кривые по Ребиндеру.
Литература.
[1] гл. 9 § 1-3.
Коллоидные поверхностно-активные вещества.
Равновесие в дисперсиях коллоидных поверхностно-активных веществ. Критическая концентрация мицеллообразования. Строение мицелл. Солюбилизация. Моющее действие мыл.
Литература.
[1] гл. 11 § 1-3.
Раздел 7. Грубодисперсные системы.
Особенности микрогетерогенных систем. Классификация.
Эмульсии, классификация, свойства, получение. Эмульгаторы. Обращение фаз. Разрушение эмульсий. Значение эмульсий.
Суспензии, их особенности, получение, свойства. Значение суспензий.
Пены, их получение, свойства. Пенообразователи. Устойчивость пен. Пеногасители. Значение пен.
Аэрозоли, их классификация, свойства, получение. Разрушение аэрозолей. Значение аэрозолей.
Порошки, их свойства.
Литература.
[1] гл. 10 § 1-6.
Раздел 8. Высокомолекулярные соединения и их растворы.
Природные и синтетические высокомолекулярные соединения. Строение макромолекул. Гибкость, эластичность, пластичность. Фазовые и физические состояния полимеров.
Набухание, его стадии. Явления, сопровождающие набухание. Образование студней. Растворение высокомолекулярных соединений.
Коацервация. Высаливание. Защитное действие высокомолекулярных соединений. Высокомолекулярные электролиты. Значение процессов набухания, застудневания в пищевых производствах.
Литература.
[1] гл. 12 § 1-6, гл. 13 § 1-7.
Литература.
1. А. Б. Лукьянов «Физическая и коллоидная химия» – М. «Химия», 1980.
2. Д.Л. Шамшин "Физическая и коллоидная химия" – М. "Высшая школа", 1968.
3. О.С. Гамеева "Сборник задач и упражнений по физической и коллоидной химии" – М. "Высшая школа", 1980.