ЛАБОРАТОРНАЯ РАБОТА № 5
ЦЕЛЬ РАБОТЫ: Оценить эффективность термической стерилизации суспензии микроорганизмов кинетическими методами.
1) ПРОГРАММА ТЕОРЕТИЧЕСКОЙ РАБОТЫ
1) Асептика, асептические условия, стерильность.
2) Какое влияние оказывает посторонняя микрофлора на эффективность
микробиологических производств? Приведите примеры.
3) Каким образом обеспечивается достижение и поддержание асептических
условий на стадии ферментации?
4) Термическая стерилизация.
5) Химическая стерилизация.
6) Стерилизация ионизирующим излучением.
7) Фильтрующая стерилизация.
8) Проанализируйте существующие способы и режимы стерилизации. Какие пути повышения эффективности режимов стерилизации жидкостей вызнаете?
9) Методы и режимы получения стерильного воздуха
2) ПРОГРАММА ПРАКТИЧЕСКОЙ РАБОТЫ
1) Ознакомиться с основными сведениями о процессе фильтрации культуральных жидкостей и способах их обработки.
2). Сравнить фильтрационные характеристики культуральной жидкости грибного происхождения до и после обработки культуральной жидкости.
3). Определить длительность процесса фильтрации культуральной жидкости.
4.) Рассчитать общее сопротивление фильтрации культуральной жидкости.
5.) Освоить методику определения динамической вязкости культуральной жидкости.
6.) Изучить методы предварительной обработки культуральной жидкости, а именно тепловую коагуляцию.
3 ОСНОВНЫЕ СВЕДЕНИЯ
Активность клеток, спор и вирусов в воздухе или жидких средах может снижаться в результате их разрушения (под воздействием тепла, радиации, химических агентов или механических сил), при механическом отделении (фильтрованием или центрифугированием) или за счет ингибирования (при переохлаждении, высушивании, обезвоживании, воздействии химических реагентов). Жидкости стерилизуют в основном путем нагревания (в промышленности) или хлорирования (для бытовых нужд), а для стерилизации воздуха применяют главным образом фильтрование.
На рис.3.1 изображены результаты экспериментального изучения воздействия повышенной температуры на вегетативные клетки и споры. В общем случае по сравнению со спорами клетки погибают при нагревании гораздо быстрее. Это и понятно, если учесть, что образование эндоспор, как мы уже отмечали ранее, представляет собой защитный механизм, позволяющий некоторым клеткам переносить неблагоприятные условия. Тепловая обработка приводит также к инактивации вирусов и бактериофагов, поэтому использующаяся в микробиологической промышленности тепловая стерилизация снижает как численность популяции жизнеспособных микроорганизмов, так и концентрацию (титр) вирусов в подаваемом в реактор потоке питательных веществ. Прежде чем перейти к изучению уравнений, описывающих скорость снижения численности популяции в процессе стерилизации, необходимо сделать ряд замечаний. Гибель каждой конкретной клетки, по-видимому, обусловливается термической денатурацией одного или нескольких жизненно важных для этой клетки белков, например ферментов. Кинетика подобных кооперативных превращений столь сложных молекул может изменяться во времени самым неожиданным образом. К тому же, скорость молекулярных процессов, приводящих в конце концов к гибели клетки зависит от состава среды, в том числе и от концентрации растворителя. Например, температура, при которой наступает коагуляция (денатурация с последующей интенсивной необратимой сшивкой молекул денатурированного белка) альбумина яичного белка, повышается с уменьшением содержания в системе воды.
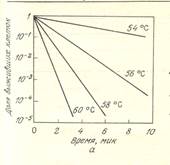
Рис 3.1. Скорость гибели E.coli в буферном растворе
Эти данные и ряд других экспериментально обнаруженных фактов свидетельствуют о том, что в случае сравнительно обезвоженных организмов и структур (вирусов или спор) их инактивацию правильнее рассматривать как двухэтапный процесс, при котором сначала проходит гидратация, а затем денатурация. Совместное влияние нескольких инактивирующих факторов не обязательно носит аддитивный характер; так совместное обезвоживание и тепловая обработка могут быть менее эффективными, чем можно было предположить, судя по эффективности каждого из этих факторов в отдельности.
Популяция состоит из множества клеток различного возраста. Природа клеточной стенки и относительная важность любого из путей метаболизма зависят от возраста, данной клетки и культуры в целом. Следовательно, устойчивость клеток к тепловой или индуцированной иными факторами инактивации будет зависеть от их истории, т. е. от довольно неопределенного фактора, который далеко не всегда удается охарактеризовать количественно. В частности, клетки популяции, находящейся в фазе экспоненциального роста, имеют относительно проницаемые стенки, что способствует эффективному обмену растворенными веществами между внутриклеточным объемом и средой. Если эти растворенные вещества влияют на устойчивость белков, то можно ожидать, что их присутствие окажет влияние и на рост клеток в экспоненциальной фазе. Поэтому наиболее надежные данные о поведении популяции могут быть получены только в результате экспериментов в условиях, максимально приближенных к условиям предполагаемого практического проведения процесса.
Гибель части клеток в процессе роста популяции учитывается большинством моделей как процесс, протекающий параллельно и независимо от размножения жизнеспособных особей той же культуры.
В ряде случаев, а именно при стерилизации жидких и твердых сред, оборудования, вспомогательных материалов, гибель части или всех клеток становится целью процесса.
Такая постановка задачи требует таких методов решения, которые способны гарантировать заданную степень асептики и воспроизводить результаты в промышленных условиях при длительной эксплуатации установок.
Основным методом стерилизации жидкостей и аппаратуры в лабораторных условиях является термический, связанный с достаточно длительным прогревом до заданной температуры.
Гибель микроорганизмов при повышенной температуре происходит, как правило, со скоростью, пропорциональной концентрации клеток или спор, еще сохранивших жизнеспособность к данному моменту времени:
- dN0 /dt =KN, (1)
где К— удельная скорость гибели;
N — число жизнеспособных клеток.
Если в начальный момент времени при х = 0, число жизнеспособных клеток составляло No, то ко времени τ= 0оно достигает величины N.
ln (N0/N) = K τ, (2)
откуда:
K = 1/ τ ln (N0/N), (3)
где ln (N0/N) – критерий стериализации.
Важной характеристикой является время, за которое число выживших клеток снижается в 10 раз. Из уравнения (2) следует: τ 10=2,303/ K.
При стерилизации жидких сред обычно задается величина критерия стерилизации. Затем по известному значению удельной скорости гибели при определенной температуре по уравнению (2) вычисляют необходимую продолжительность обработки τ.
Гибель клеток и спор резко ускоряется с ростом температуры. В интервале 100-140°С значение К возрастает в 104-105 раз; при повышении температуры на 10°С удельная скорость гибели клеток и спор возрастает в 10 раз и более.
Зависимость удельной скорости гибели клеток от температуры описывается уравнением Аррениуса:
K = A exp-E/RT (4)
Постоянную Е в этом уравнении по аналогии с химической кинетикой называют энергией активации процесса гибели микроорганизмов.
4ПОРЯДОК РАБОТЫ:
1) подсчитать N — число клеток в 1 мл суспензии микроорганизмов и оценить эффективность термической стерилизации, для чего:
2) вычислить критерий стерилизации ln (N0/N).;
3)) рассчитать удельную скорость гибели микроорганизмов при заданой температуре (Т = 65, 85, 100°С);
используя уравнение Аррениуса с найденными параметрами (A, E/R), определить значение удельной скорости гибели микроорганизмов указанных температур;
рассчитать τ 10 – время, за которое число выживших клеток
уменьшится в 10 раз.
4.1. Подсчет клеток в счетных камерах
Этот метод рекомендуется использовать для подсчета крупных объектов - дрожжей, одноклеточных водорослей, конидий грибов и некоторых относительно крупных бактерий. Обычно используют камеру Горяева-Тома (рис. 5.1), хотя можно применять и другие.
Эта камера представляет собой толстое предметное стекло, разделенное бороздками. На центральную часть стекла нанесена сетка. Площадь квадрата сетки указана на одной из сторон предметного стекла и соответствует 1/25 мм2 (большой квадрат) или 1/400 мм2 (малый квадрат). Часть предметного стекла, на 0,1 мм ниже двух других сторон. Это глубина камеры, она всегда указывается на предметном стекле.
Рис. 5.1 Камера Горяева-Тома: а) вид сверху; б) вид сбоку; в) вид сетки камеры при малом увеличении микроскопа
При работе с камерой необходимо соблюдать определенный порядок ее заполнения. Вначале углубление с сеткой покрывают специальным шлифованным покровным стеклом и, слегка прижимая, смещают покровное стекло в противоположные стороны до появления колец Ньютона. Это указывает на то, что покровное стекло притерто к сторонам камеры. Только при таком условии объем взвеси микроорганизмов, находящихся в камере, соответствует расчетному. Суспензию вносят через бороздку камеры капилляром или пипеткой.
Подсчет клеток рекомендуется начинать через 3-5 минут после заполнения камеры, чтобы клетки осели и при микроскопировании были видны в одной плоскости. Подвижные клетки перед заполнением камерыубивают нагреванием или суспендированием в 0,5%-ном водном растворе формалина. Число клеток подсчитывают с объективом 8х или 40х. С иммерсионным объективом работать нельзя, так как его фокусное расстояние меньше толщины стекла камеры. Обычно подсчитывают клетки микроорганизмов в 10 больших или 20 маленьких квадратах сетки, перемещая последние по диагонали. Учитывают все клетки, лежащие в квадрате сетки, а также клетки, пересекающие верхнюю и правую сторону квадрата. При подсчете количество кпеток в большом квадрате не должно превышать 20, а в малом - 10, в противном случае исходную суспензию разводят водопроводной водой. Для получения достоверного результата общее число подсчитанных клеток микроорганизмов должно быть не менее 600.
Точность определения зависит от того, насколько плотно пришлифовано покровное стекло к поверхности камеры, поэтому подсчет клеток повторяют 3-4 раза, каждый раз заново монтируя камеру и заполняя ее исследуемой взвесью микроорганизмов. Это обеспечивает большую точность, чем подсчет 600 клеток при однократном монтаже камеры. Число клеток N в 1 мл исследуемой суспензии вычисляют по формуле:
N =a 103 n / h S, (5)
где N - число клеток в 1 мл суспензии;
а - среднее число клеток в квадрате сетки;
h - глубина камеры в мм;
S - площадь квадрата сетки в мм2;
103 - коэффициент перевода см3 в мм3;
п - кратность разведения исследуемой суспензии.
4.2 Оценка эффективности термической стерилизации
Разлить исходную суспензию микроорганизмов по 3-5 мл в пробирки. Примечание: в качестве точки отсчета оставить нулевую пробу.
Поместить пробирки в термостат (или на водяную баню) при температуре 65 °С.
Отбирать пробы через определенные промежутки времени (15 минут) в течение часа.
Определить число клеток в пробах с использованием метода простого окрашивания и подсчета в счетных камерах Горяева-Тома.
По полученным данным построить зависимость N=f(τ)), где N - число клеток в объеме проб микробной суспензии.
Вычислить удельную скорость гибели микроорганизмов К из уравнения
K = 1/ τ ln (N0/N), (3)
Согласно описанному выше, выполнить эксперименты при других температурах (75 и 90-95°С).
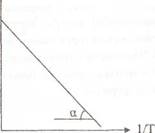
Построить графическую зависимость в координатах In К= f(1/T) (Т в градусах Кельвина) (рис. 3.2). Из графика найти tgά и точку пересечения с осью ординат.
 1пК А
1пК А
1пА
Рис.
5.2 Графическая зависимость K от 1/T
В линеаризованном виде уравнение Аррениуса (4) Может быть записано как
ln K = ln A- E/RT (5)
Здесь ln А определяется из графика как величина, численно равная величине отрезка, отсекаемого прямой на оси ординат, а E/R – tgά.
Таким образом, значение удельной скорости гибели определяется из уравнения Аррениуса с найденными константами — А и E/R.
Эффективность стерилизации может быть оценена для любой температуры: так как А, Е, R – постоянные величины, подставив в уравнение Аррениуса (4) любое значение Т, рассчитывается К.
Зная No и задав N, из уравнения K = 1/ τ ln (N0/N) легко найти τ.
Далее следует определить Тю - 2,303/Л" - время, за которое концентрация выживших клеток уменьшится в 10 раз.
Сделать обобщающие выводы по полученным экспериментальным данным и результатам расчетов.
СПИСОК ЛИТЕРАТУРЫ
1. Бирюков В.В. Основы промышленной биотехнологии. / В.В. Бирюков М.: КолосС, 2004. – 296 с.
2. Сазыкин Ю.О. Биотехнология. / Ю.О. Сазыкин, С.Н. Орехов, И.И. Чакалева; под ред. А.В. Катлинского. – М.: Издательский центр «Академия», 2006. – 256 с.
3. Основы фармацевтической биотехнологии / Т.П. Прищеп В.С.Чучалин, К.Л. Зайков // Ростов-на-Дону; Феникс, Томск: Издательство НТЛ, 2006. –д 256 с.
4. Основы биотехнологии: Учебно-методическое пособие / А.С. Сиротин Р.К. Закиров, Г.И.Шагинурова, В.Б. Жукова идр.; Казан. Гос.технол.ун-т Казань,206.100 с.
5. Дж. Бейли, Д. Оллис. Основы биохимической инженерии. Пер с англ. В 2-х частях. Ч 1. / М.: Мир, 2004.. – 692 с.
6. Микробная биотехнология /Лещинская И.Б., Куриненко Б.М.,Вершинина В.И. и др. - Казань: Унипресс ДАС, 2000. - 368 с.
7. Блинов Н.П. Основы биотехнологии. - С-Пб.: Наука, 1995. - 600 с.
8. Биотехнология, т. 1 /Под ред. Егорова Н.С., Самуилова В.Д. - М.:Высшая школа, 1987.
9. Бекер М.Е., Лиепиныш Г.К., Райпулис Е.П. Биотехнология. - М.: Агропромиздат, 1990. - 334 с.
10. Промышленная микробиология /Под ред. Егорова Н.С. - М.: Высшая школа, 1989.-688 с.