Рассмотрим гомогенную обратимую реакцию:
Н2(г) + I2(г) ↔ 2НI(г)
В начальный момент времени при смешении в сосуде исходных веществ (Н2 и I2) скорость прямой реакции определяется начальными концентрациями этих веществ и будет большой, а скорость обратной реакции (Vобр) равна нулю, так как концентрация продукта реакции НI в начальный момент времени равна нулю. По мере протекания прямой реакции исходные вещества Н2 и I2 расходуется и поэтому их концентрации уменьшаются, в результате этого уменьшается и скорость прямой реакции (Vпр). По мере протекания прямой реакции в сосуде образуется продукт реакции НI, концентрация которого с течением времени увеличивается, поэтому и скорость обратной реакции (Vобр) тоже увеличивается. Когда скорости прямой и обратной реакций становятся равными (в момент времени t равн), наступает (устанавливается) химическое равновесие между водородом Н2, йодом I2 и НI, то есть число образуемых и распавшихся молекул НI в единицу времени становятся одинаковыми, поэтому концентрация Н2, I2 и НI c течением времени не изменяются, то есть постоянны во времени.
По закону действующих масс, скорости прямой и обратной реакции выражаются следующим образом:
Vпр = k1 ·С(Н2) · С(I2)
Vобр = k2· C2(HI)
При наступлении химического равновесия: Vпр. = Vобр k1 ·С(Н2) · С(I2)=k2· C2(HI)
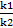 =
= 
Так как константы скорости k пр. и k обр. при данной температуре постоянны, то и их отношение k пр. / k обр. тоже будет постоянной величиной и называется константой химического равновесия данной реакции (обозначается большой буквой К).
Таким образом, К = 
Для гомогенной обратимой реакции в общем виде:
аА + bB ↔ dD + eE
константа равновесия будет равна: К= 
Таким образом, константа химического равновесия обратимой реакции равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ (при этом концентрации веществ берутся в степенях, равных коэффициентам в уравнении обратимой реакции).
Константа равновесия (К) характеризует степень протекания прямой и обратной реакций, показывает, куда смещено химическое равновесие (влево или вправо) и характеризует выход продуктов реакции. Если К намного больше единицы (например, 10), то равновесие смещено вправо (à) и выход продуктов реакции (веществ D и E) будет большим. И, наоборот, если константа равновесия намного меньше единицы например, 10-3), то равновесие смещено влево в сторону исходных веществ (ß), поэтому выход продуктов реакции будет мал.
Константа равновесия (К ) зависит:
1) от природы реагирующих веществ;
2) от температуры.
Константа равновесия (К ) не зависит:
1) от концентрации веществ;
2) от присутствия катализатора.
Если рассмотрим гетерогенную обратимую реакцию, например:
СО2(г) + С(тв) ↔2СО(г),
то константа равновесия будет в этом случае равна:
К= 
Концентрация твердого углерода С(ТВ) будет практически постоянной величиной и поэтому не входит в выражение константы равновесия.
Химическое равновесие остается неизменным до тех пор, пока условия равновесия, при которых оно установилось, сохраняются постоянными. При изменении условий равновесия прямая и обратная реакция начинают протекать с разными скоростями, и равновесие нарушается. Через некоторое время скорости прямой и обратной реакций станут равными и в системе вновь наступит равновесие, но уже с новыми равновесными концентрациями всех веществ. Переход системы из одного равновесного состояния в другое называется смещением равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в направлении ослабляющем эффект внешнего воздействия.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ
1. Давление (характерно для газов).
Когда в реакциях участвуют газы, равновесие может нарушиться при изменении давления. При увеличении давления в системе равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону реакции, идущей с возрастанием числа молекул газов, т.е. в сторону увеличения давления.
2. Температура.
При повышении температуры равновесие смещается в направлении эндотермической, при понижении – в направлении экзотермической реакции.
3. Концентрация.
При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции (в сторону прямой реакции). При увеличении концентраций продуктов реакции или уменьшении концентраций исходных веществ равновесие смещается в сторону исходных веществ (в сторону обратной реакции).
4. Катализаторы.
Катализаторы не смещают равновесия. Они уменьшают время, необходимое для достижения равновесия. Во сколько раз катализаторы ускоряют прямую реакцию, во столько же раз они ускоряют и обратную реакцию.
Например, при нагревании равновесие обратимой реакции 3Н2 (г) + N2 ↔ 2NH3 +Q смещается влево (ß), а при охлаждении (à).
При повышении давления равновесие обратимой реакции смещается вправо (à), а при понижении давления – влево (ß).
Увеличение концентрации исходных веществ (Н2 или N2) будет смещать равновесие вправо (à), а при уменьшении концентрации этих веществ – влево (ß). При увеличении концентрации продукта реакции (NH3) равновесие смещается влево (ß), а при уменьшении концентрации NH3 – вправо (à).