Факторы,влияющие на степень диссоциации
Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации a и исходную концентрацию вещества c в растворе. На степень диссоциации слабых электролитов влияет и добавление одноименных ионов. Так, введение в равновесную стему несильного электролита увеличивает концентрацию ионов, что в соответствии с принципом Ле Шателье приводит значительному сдвигу равновесия диссоциации влево, т. е. уменьшению степени диссоциации. Таким образом, добавление к раствору слабого электролита одноименных ионов уменьшает степень его диссоциации.
По величине степени диссоциации все электролиты делятся на сильные и слабые. Сильные электролиты – это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4, HMnO4, HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2). В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. Степень диссоциации сильных электролитов α>30%.
Слабые электролиты – это вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Степень диссоциации α<3%. К слабым электролитам относятся почти все органические кислоты (CH3COOH, C2H5COOH и др.); некоторые неорганические кислоты (H2CO3, H2SO3, H2SiO3, HCN, HNO2, H3PO4, HF, H2S, HClO, HClO2, HBrO, и др.); почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); вода. Они плохо (или почти не проводят) электрический ток.
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Для слабых электролитов диссоциация –это обратимый процесс, в какой-то момент устанавливается равновесие: СН3СООН ↔ СН3СОО- + Н+, константа которого (константа диссоциации) равна: К= 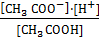
РЕАКЦИИ ИОННОГО ОБМЕНА
Реакции между ионами, образовавшимися в результате диссоциации электролитов, называются реакциями ионного обмена.
Правила составления ионных уравнений реакций
1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют и на ионы не расписываются.
2. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
Порядок составления ионных уравнений реакции
1. Записывают молекулярное уравнение реакции:
MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2
2. Определяют растворимость каждого из веществ с помощью таблицы растворимости:
MgCl2 + 2AgNO3 = 2AgCl↓ + Mg(NO3)2
3. Записывают полное ионное уравнение реакции
Mg2+ + 2Clˉ + 2Ag+ + 2NO3ˉ = 2AgCl↓ + Mg2+ + 2NO3ˉ
5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Mg2+ + 2Clˉ + 2Ag+ + 2NO3ˉ = 2AgCl↓ + Mg2+ + 2NO3ˉ
Ag+ + Clˉ = AgCl↓
Условия необратимости реакций ионного обмена
1. Если образуется осадок (↓):
Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3
Pb2+ + 2Iˉ = PbI2↓
2. Если выделяется газ (↑):
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑
3. Если образуется малодиссоциированное вещество (H2O):
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
H+ + OHˉ = H2O
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O), реакции обмена обратимы.
Теория кислот и оснований
На основании теории электролитической диссоциации Аррениус дал новые определения основаниям, кислотам и солям.
Кислоты – это электролиты, диссоциирующие с образованием катионов водорода Н+:
HNO3 = H+ + NO3ˉ
Диссоциация многоосновных кислот протекает по ступеням:
H3PO4 = H+ + H2PO4ˉ I ступень
H2PO4ˉ = H+ + HPO42ˉ II ступень
HPO42ˉ = H+ + PO43ˉ III ступень
Основания – это электролиты, диссоциирующие с образованием гидроксид-ионов ОНˉ:
NaOH = Na+ + OHˉ
Если основание содержит в молекуле несколько гидроксильных групп, то диссоциация будет происходить ступенчато:
Сa(OH)2 =СаОН+ + OHˉ I ступень
СaOH+ =Сa2+ + OHˉ II ступень
Уравнение полной диссоциации имеет следующий вид:
Сa(OH)2 = Сa2+ + 2OHˉ
Диссоциацию растворенной части амфотерного гидроксида можно представить следующей схемой:
H+ + МеO– = МеOH = Ме+ + OH –.
В насыщенном водном растворе амфотерного гидроксида ионы H+, МеO– и Ме+, OH– находятся в состоянии равновесия, поэтому амфотерные гидроксиды взаимодействуют и с кислотами и с основаниями. При добавлении кислоты равновесие смещается в сторону диссоциации по типу основания, при добавлении основания – в сторону диссоциации по типу кислоты.
Соли – это электролиты, диссоциирующие с образованием катионов, отличных от ионов Н+, и анионов, отличных от ионов ОНˉ:
NaCl = Na+ + Clˉ
KHCO3 = K+ + HCO3ˉ
AlOHCl2 = AlOH2+ + 2Clˉ