К этой группе относятся: марганец, технеций, рений. Электронное строение: Mn:..3d5, 4s2; Tc:..4d5, 5s2; Re..5d5, 6s2. Возможные степени окисления: для Mn: +2, +3, +4, +6, +7; Tc: +2, +4, +6, +7; Tc +2, +3, +4, +6, +7.
8.7.1. Способы получения
Mn в свободном виде – термическое восстановление оксидов или галогенидов: MnO2+Si  Mn+SiO2 Наиболее чистый – электролиз раствора MnSO4. Соединения технеция выделяются из отходов атомной энергии, в свободном виде – восстановление водородом: Tc2S7+7H2=2Tc+7H2S. Свободный Re: Re2S7+7H2=2Re +7H2S
Mn+SiO2 Наиболее чистый – электролиз раствора MnSO4. Соединения технеция выделяются из отходов атомной энергии, в свободном виде – восстановление водородом: Tc2S7+7H2=2Tc+7H2S. Свободный Re: Re2S7+7H2=2Re +7H2S
8.7.2. ХИМИЧЕСКИЕ СВОЙСТВА
Взаимодействуют со многими реагентами, проявляя степени окисления от +2 до +7. Химическая активность понижается от марганца к рению (Mn расположен до водорода в ряду напряжений, а Tc и Re после него). При комнатной температуре в порошкообразном состоянии – окисляются во влажном воздухе. С водородом не реагируют, с азотом только марганец: Mn+N2  MnxNy; Mn+S
MnxNy; Mn+S  MnS, MnS2(TcS2, ReS2); Mn+ Г2
MnS, MnS2(TcS2, ReS2); Mn+ Г2  MnГ2 (TcГ6 ReГ5 ReГ6)
MnГ2 (TcГ6 ReГ5 ReГ6)
Mn+O2  MnO, Mn2O3, MnO2 (Tc, Re =Э2О7)
MnO, Mn2O3, MnO2 (Tc, Re =Э2О7)
С H2SO4(разб.), Н2О, HCI, HNO3(конц.), HF реагирует только марганец: Mn+2H2O=Mn(OH)2+H2;
Mn+ H2SO4(разб.)=MnSO4+H2; Mn+2HF=MnF2+H2
Mn+2HCI=MnCI2+H2
Mn+4HNO3(конц.)  Mn(NO3)2+2NO2+2H2O
Mn(NO3)2+2NO2+2H2O
2Re (Tc)+ 7H2SO4(конц.)=2HReO4 +7SO2+6H2O
3Re (Tc)+7HNO3(разб.)=3HReO4 +7NO+2H2O
Mn+4HNO3(разб.)=Mn(NO3)2+2NO+2H2O
8.7.3. СОЕДИНЕНИЯ элементов
В бинарных соединениях проявляют степени окисления от +2 до +7. Устойчивость соединений с низшими степенями окисления (+2, +3, +4) от марганца к рению снижается, а с высшими (+6, +7) растет. Поэтому соединения марганца (+6 и +?) – сильные окислители, а соединения рения и технеция в низших степенях окисления – хорошие восстановители.
Галогениды марганца известны только для низших степеней окисления (+2, +3, +4), они хорошо растворимы в воде, а некоторые из них существуют только в водном растворе.
У технеция и рения более устойчивы соединения высших степеней окисления.
Все оксиды (кроме жидкого Mn2O7) при обычных условиях – твердые вещества. Устойчивость оксидов ЭО, Э2О3, ЭО2 в ряду Mn-Re уменьшается, а Э2О5, ЭО3, Э2О7 - увеличивается. Оксиды марганца в степенях окисления +2, +3, +4 получают при окислении марганца: 6Mn+3O2  6MnO+3O2
6MnO+3O2  6MnO2
6MnO2 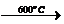 3Mn2O3
3Mn2O3  2Mn3O4
2Mn3O4
При взаимодействии технеция и рения с кислородом образуются оксиды Э2О7.
Способы получения оксидов: 1) термическое разложение солей и гидроксидов: Mn(OH)2=MnO+H2O; Mn(NO3)2=MnO2+2NO2 восстановление или окисление соединений: 3Mn2O3+KCIO3=6MnO2+KCI; ReO2+Re2O7=3ReO3
Оксиды в воде практически нерастворимы, со щелочами и кислотами образуют гидроксиды и соли, в степенях окисления +3, +4 и выше – сильные окислители: MnO2+4HCI=MnCI2+CI2+2H2O; Re2O7+SO2=2ReO3+SO3
Гидроксиды в степенях окисления +2, +3, +4 - малорастворимые в воде осадки, с проявлением основных свойств, в +6, +7 = типичные кислоты. Н2ЭО4 – неустойчивы даже в водных растворах и диспропорционируют: 3Н2ЭО4=ЭО2+2НЭО4+2Н2О. Большинство солей марганца, технеция и рения хорошо растворимы в воде. KMnO4 - сильнейший окислитель.
Применение. Из всех элементов наибольшее применение находит марганец – в металлургии. Это один из важнейших компонентов при производстве сталей, а также при производстве высокопрочных сплавов, в качестве катализаторов. Соединения технеция – в качестве ингибиторов коррозии в ядерных реакторах. Рений – в радиоэлектронике, при производстве специальных сплавов.