Большинство твердых тел находится в кристаллическом состоянии, которое характеризуется дальним порядком, то есть трехмерной периодичностью структуры по всему объему твердого тела (кристаллической решеткой). Кристаллические вещества имеют определенную температуру плавления, энергию и постоянную кристаллической решетки и координационное число. Координационным числом называется число частиц, непосредственно примыкающих к данной частице в кристалле. Постоянная решетки характеризует расстояние между центрами частиц, занимающих узлы в кристалле. Энергия кристаллической решетки - это энергия, необходимая для разрушения 1 моль кристалла и удаления частиц за пределы их взаимодействия. По природе частиц в узлах кристаллической решетки и природе химических связей между ними все кристаллы делятся на молекулярные, атомно-ковалентные, ионные и металлические. Кроме того, существуют кристаллы со смешанными химическими связями.
Молекулярные кристаллы. В узлах решетки находятся молекулы, между которыми действуют вандерваальсовы силы или водородные связи. Энергия кристаллической решетки невысока (5-25 кДж/моль), молекулярные кристаллы имеют низкие температуры плавления и кипения. Основные свойства кристаллов приведены в таблице 1.
Атомно-ковалентные кристаллы. В узлах кристаллов располагаются атомы, связанные ковалентными связями. Это обуславливает высокую энергию решетки и физические свойства веществ. Из-за направленности ковалентных связей координационные числа и плотность упаковки в атомно-ковалентных кристаллах обычно невелики. Свойства кристаллов см в табл. 1.
Ионные кристаллы. Структурные единицы - ионы, связанные между собой силами электростатического взаимодействия. Энергия кристаллической решетки велика. Свойства кристаллов приведены в таблице 1.
Металлические кристаллы и связь. Большинство элементов периодической таблицы Д.И. Менделеева относятся к металлам, которые имеют общие свойства: высокую электропроводность (106 - 108 См), теплопроводность, ковкость, пластичность, металлический блеск, высокую отражательную способность по отношению к свету. Общие свойства металлов можно объяснить особым типом химической связи, называющейся металлической. У большинства металлов на внешней электронной оболочке имеется значительное число вакантных орбиталей и малое число электронов. Поэтому энергетически более выгодно, чтобы электроны были не локализованы, а принадлежали всему металлу. По теории свободных электронов в узлах решетки находятся катионы металла, погруженные в электронный «газ». Между ионами металла и нелокализованными электронами существует электростатическое взаимодействие. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Свойства кристаллов приведены в таблице 1.
Кристаллы со смешанными связями. Тот или иной вид химической связи или взаимодействия в чистом виде в кристаллах встречается редко. В некоторых молекулярных кристаллах (Н2О, Н2О2, НF) наряду с вандерваальсовыми возникают водородные связи, которые значительно упрочняют кристаллы. Ионная связь в чистом виде практически не существует, так как в ионных кристаллах также действует ковалентная связь, поэтому можно говорить о той или иной степени ионности. В атомных кристаллах наряду с ковалентной связью могут существовать вандерваальсовы силы, например, у графита.
Таблица 1 Типы кристаллов и свойства веществ
| Вид частиц в узлах, свойства веществ | Тип кристаллов | |||
| молекулярные | Атомно-ковалентные | ионные | Металлические | |
| Частицы | Молекулы | Атомы | Ионы | Ионы |
| Тип связей между частицами | Вандерваальсов ы силы, водородные | Ковалентные | Ионные | Металлические |
| Энергия связей | Невысокая | Высокая | Высокая | От средней до высокой |
| Температура плавления | Низкая | Высокая | Высокая | От низкой до высокой |
| Механические свойства | Мягкие | Очень твердые | Твердые и хрупкие | От мягких до очень твердых |
| Электрическая проводимость | Диэлектрики | От диэлектриков до | диэлектрики | Электронная |
Тема: Химическая термодинамика
План
1. Общие закономерности протекания химических процессов
2. Первый закон термодинамики. Энтальпия.
3. Законы Гесса и Лавуазье-Лапласа.
4. Второй, третий законы термодинамики. Энтропия.
5. Направленность химических процессов. Свободная энергия Гиббса.
При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Химическая система представляет собой частный случай термодинамической. Если между системой и окружающей средой отсутствует массо- и теплообмен, то она называется изолированной. Если отсутствует массообмен, но возможент теплообмен, то система является закрытой. Система может быть также открытой (возможен и массо- и теплообмен).
Система, состоящая из нескольких фаз, называется гетерогенной, однофазная система - гомогенной.
Состояние системы определяется термодинамическими параметрами (р, С, Т, V и другими). Изменение хотя бы одного из параметров влечет за собой изменение состояния системы. В термодинамике свойства системы рассматривают при ее равновесном состоянии. В настоящее время развивается термодинамика неравновесных процессов, но ее изучение не входит в нашу задачу.
Состояние системы называют равновесным, если его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно во времени. Термодинамика изучает переходы системы из одного состояния в другое, переходы химической энергии в другие виды (тепловую, электрическую и др.), устанавливает количественные законы этих переходов, а также направление и пределы самопроизвольного протекания химических реакций в заданных условиях.
Если процессы перехода системы происходят при постоянстве каких-либо параметров, то они называются:
1) изобарными (р=const, либо Δр=0);
2) изохорными (V=const, либо ΔV=0);
3) изотермическими (Т=const, либо ΔT=0);
4) адиабатическими (q-const, либо Δq=0).
Состояние системы можно представить в виде уравнения состояния, связывающего все параметры системы: f (р, V, Т)=0.
Конкретный вид уравнения состояния известен лишь для ограниченного числа наиболее простых объектов. Например, уравнение Клапейрона-Менделеева описывает состояние идеального газа. Для большинства реальных систем уравнение состояния в явном виде неизвестно, поэтому для термодинамического описания системы используют функции состояния, которые называют также характеристическими функциями: внутреннюю энергию U, энтальпию Н, энтропию S, энергию Гиббса G, энергия Гельмгольца F. Значения этих функций не зависят от характера процессов, приводящих систему к данному состоянию, и определяется только параметрами системы (р, V, Т, С).
Внутренняя энергия, теплота и работа. В любом процессе соблюдается закон сохранения энергии. Энергия не может ни создаваться, ни исчезать, а только превращаться из одного вида в другие. Количественные соотношения между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики, который является формой выражения закона сохранения энергии: Q = ΔU+А.
Для изобарно-изотермического процесса, когда на систему не действуют никакие другие силы, кроме постоянного давления, единственным видом работы является работа расширения рΔV, тогда Q Р,т = ΔU+рΔУ. Подставим ΔU=U2–U1,а также ΔV=V2-V1 получим: Qр,т = U2–U1+pV2–pV1 = (U2+pV2)–(U1+pV1). Функция Н = U+рV называется энтальпией, и ΔН= Qp, T.
Тепловой эффект реакции. Изменение энергии системы при протекании в ней химической реакции в изобарно-изотермических условиях называется тепловым эффектом реакции Qp, T. Он равен изменению ΔН.
Если ΔН реакции меньше нуля, то в процессе реакции теплота выделяется и процесс называется экзотермическим. При ΔН реакции больше нуля - эндотермическим.
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект реакции называется стандартной энтальпией реакции и обозначается ΔН°298. Стандартные условия: Т = 298 К, р = 101,3 кПа. Для идеального раствора с = 1 моль/л. Для реального раствора активность а=1 моль/л.
Термохимия. Законы Лавуазье-Лапласа. Термохимия изучает тепловые эффекты химических реакций и фазовых превращений. Уравнения процессов, в которых указаны тепловые эффекты и агрегатные (фазовые) состояния, называются термохимическими. Например, Н2(Г) + ½ О2(г) = H2O(ж) + 285,8 кДж. Чаще используют вторую форму записи: Н2(Г) + ½ О2(г) = H2O(ж); ΔН°298 = -285,8 кДж.
Энтальпия образования. Тепловой эффект образования 1 моль вещества из простых веществ в стандартных условиях называют теплотой образования. Обозначают АН°обр.
Энтальпию образования простых веществ, устойчивых в стандартных условиях, принимают равной 0. Стандартными условиями считают: Т = 298 К, р = 101,3 кПа. Для идеального раствора с = 1 моль/л.
В основе термохимических расчетов лежат:
1) Закон Гесса: тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, то есть числа и характера промежуточных стадий.
2) Закон Лавуазье-Лапласа: теплота, выделяющаяся при образовании сложного вещества из простых, равна теплоте, поглощаемой при разложении такого же количества его на составные части.
Расчеты проводят с использованием термохимических уравнений, которые отличаются от химических тем, что в них указаны агрегатные состояния веществ и Теловой эффект реакции. Например, NН3(Г) + НС1(г) = NН4С1(К), ΔН=-176,9 кДж. Здесь г -газообразное, к - кристаллическое, ж - жидкое, тв - твердое агрегатное состояние.
Согласно следствию из закона Гесса ΔН химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ, с учетом стехиометрических коэффициентов. Для уравнения аА + вВ = сС + дД
ΔН°х.р. = ΣΔН°обр.прод. - ΣΔН°обр.исх. = сΔН°с + дΔН°д -(аΔН°А+вΔН°B), кДж.
По этому уравнению можно рассчитать АН°Х.Р., энергию химической связи, энергию кристаллической решетки, теплоту сгорания топлива, калорийность пищи, энергию фазового перехода и полиморфных превращений.
Знание ΔН°Х.Р. позволяет судить о возможности самопроизвольного протекания процесса. Всегда самопроизвольно протекают экзотермические процессы, то есть имеющие ΔН°Х.Р. меньше нуля. Но иногда и эндотермические реакции могут протекать самопроизвольно.
Энтропия системы. Движущей силой самопроизвольного процесса может быть также стремление частиц (молекул, ионов, атомов) к хаотичному движению, а системы - к переходу от более упорядоченного к менее упорядоченному состоянию. Мерой неупорядоченности состояния системы служит термодинамическая функция, называемая энтропией - S, Дж/моль·К. В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии. Энтропия идеального кристалла при абсолютном нуле равна 0. Этот постулат Планка называют третьим законом термодинамики. Энтропия образования индивидуальных веществ в стандартных условиях обозначается S°298 и ее изменение рассчитывается также, как и для энтальпии химической реакции:
ΔS°Х.Р. = ΣS0прoд. - ΣS°исх., Дж/К.
Значение ΔS°х.р. может также в какой-то степени позволить судить о термодинамической возможности протекания процесса. Одна из формулировок второго закона термодинамики: в изолированных системах самопроизвольно протекают только такие процессы, которые сопровождаются возрастанием энтропии. Второй закон термодинамики справедлив лишь для систем, состоящих из очень большого числа частиц, то есть имеет статистический характер. Реальные химические системы практически не бывают изолированными, так как они обмениваются энергией с окружающей средой. Таким образом, химические реакции обычно сопровождаются изменением как энтальпии, так и энтропии.
Критерием самопроизвольного протекания процесса является свободная энергия Гиббса ΔG°0бр., кДж/моль. Изобарно-изотермический процесс термодинамически возможен, если происходит уменьшение энергии Гиббса: ΔG °Х.Р. <0. В обратимом процессе условие ΔG °Х.Р. > 0 означает, что процесс пойдет в обратном направлении. ΔG °Х.Р. = 0 - условие термодинамического равновесия. Функция состояния ΔG °Х.Р. объединяет энтальпию и энтропию в уравнение:
ΔG °Х.Р. = ΔН°Х.Р. - Т ΔS°х.р.
Из этого уравнения видно, что самопроизвольно могут протекать и процессы, для которых ΔН°Х.Р. больше нуля, то есть эндотермические. Это возможно, когда ΔS°х.р. > 0, но Т ΔS°х.р. > ΔН°Х.Р., и тогда ΔG°Х.Р.<0. С другой стороны, экзотермические реакции (когда ΔН°Х.Р < 0) самопроизвольно не протекают, если ΔS°х.р. < 0 окажется, что ΔG °Х.Р>0.
Тема: Химическая кинетика и равновесие
План
1. Общие представления о скорости химической реакции
2. Закон действия масс.
3. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа.
4. Уравнение Аррениуса. Энергия активации химической реакции.
5. Гомогенный и гетерогенный катализ.
6. Химическое равновесие. Константа химического равновесия.
7. Принцип Ле-Шателье.
Общие представления о скорости химической реакции
Химическая кинетика - это учение о скорости химических реакций, основная ее задача - управление химическими процессами с целью обеспечения большей скорости реакции и максимального выхода продукта.
Одним из основных понятий в химической кинетике является скорость реакции. Скоростью химической реакции ύ называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
Реакции могут протекать с различными скоростями. Одни из них проходят почти мгновенно, другие - очень медленно. Скорость реакции определяется прежде всего природой реагирующих веществ. Но реакция, имеющая практически нулевую скорость при комнатной температуре, может протекать быстро при нагревании. Можно ускорить взаимодействие и при помощи катализатора. Скорость химической реакции зависит от условий протекания процесса. Итак, скорость гомогенной химической реакции измеряется изменением концентрации одного из веществ, участвующих в процессе, за единицу времени, концентрация С выражается обычно в моль/л, а время t - в минутах или секундах; поэтому размерность скорости реакции моль/л·мин или моль/л·с.
Изменение концентрации исходных веществ и продуктов реакции во времени представлена графиком:

 C
C
 2
2
 |
t
Здесь 1 - изменение концентрации исходного вещества, 2 -изменение концентрации продукта реакции.
При химической реакции концентрации исходных веществ уменьшаются во времени, а продуктов реакции - возрастает. Истинная скорость реакции определяется пределом, к которому стремится отношение ΔС/t при Δt—»0, то есть производной концентрации по времени: 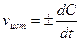 . Если измеряется скорость образования продуктов реакции, то скорость реакции положительна; если измеряется скорость расходования исходных веществ -скорость реакции отрицательна.
. Если измеряется скорость образования продуктов реакции, то скорость реакции положительна; если измеряется скорость расходования исходных веществ -скорость реакции отрицательна.
Необходимым условием осуществления химического взаимодействия между двумя молекулами должно их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени скорость реакции падает.
Закон действия масс
Закон действия масс открыт в 1867 году двумя учеными К. Гульдбергом и П. Ваге. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции mА+nВ = С этот закон выражается соотношением ύ=k[A]m[B]n
Здесь [А], [В] - концентрации реагирующих веществ в моль/л, m, n - стехиометрические коэффициенты, k - константа скорости реакции, л/моль·с. При [А]=[В]=1 моль/л ύ = k.
Следовательно, константа скорости выражает собой скорость данной реакции при условии, что концентрации реагирующих веществ равны 1 моль/л. Чем выше величина k, тем быстрее протекает данная реакция. Константа скорости зависит от температуры и природы реагирующих веществ.
Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа.
Скорость химической реакции зависит от температуры, причем при повышении температуры скорость реакции увеличивается. Голландский ученый Вант-Гофф установил, что при повышении температуры на 10° скорость большинства реакций увеличивается в 2-4 раза: 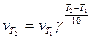
Здесь vT2 и vT1 - скорости реакций при температурах Т2 и Т1, γ -температурный коэффициент скорости реакции. Из уравнения следует, что температурный коэффициент скорости реакции равен соотношению температур, когда Т2-Т1= 10°. Величина γ показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10°. При концентрации реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости, тогда
 .
.
Константа скорости зависит от температуры так же, как и скорость.
Уравнение Аррениуса. Энергия активации химической реакции.
При повышении температуры число активных молекул возрастает и скорость реакции увеличивается. Энергию, которую надо сообщить молекулам реагирующих веществ, чтобы превратить их в активные, называется энергией активации. Ее обозначают Еа и измеряют в Дж/моль.
Величина энергии активации зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Зависимость константы химической реакции от температуры выражается уравнением Аррениуса:
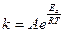
Здесь Еа - энергия активации, Дж/моль, Т - абсолютная температура, К, k - константа химической реакции, R = 8,32 Дж/моль К - универсальная газовая постоянная, А - предэкспоненциальный множитель. После логарифмирования данное уравнение можно привести к виду: ln k = ln A – Ea/RT. Если определить две константы скорости k1 и k2 при температурах Т1 и Т2, то энергию активации вычисляют по формуле
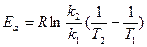
Гомогенный и гетерогенный катализ.
Одним из наиболее распространенным методом ускорения химических реакций является катализ. Этот метод заключается в том, что в реакционную систему добавляют катализаторы - вещества, резко увеличивающие скорость реакции, но не расходующиеся в результате ее протекания. Замедление реакции осуществляется при помощи ингибиторов (отрицательных катализаторов).
Различают катализ гомогенный и гетерогенный. Примером гомогенной реакции является реакция нейтрализация в растворе: НС1+КОН=KС1+Н2О. Примером гетерогенной реакции является термическое разложение карбоната кальция: СаСОз = СаО+СO2.
Скорость гетерогенной реакции зависит от площади контактирующих поверхностей. Если катализатор и взаимодействующие вещества находятся в одной фазе, катализ называется гомогенным. Если катализатор находится в системе в виде самостоятельной фазы - гетерогенным.
Влияние катализатора на скорость реакции при гомогенном катализе объясняется образованием промежуточного соединения катализатора с реагирующим веществом. Так, медленно протекающая реакция А+В=АВ ускоряется катализатором К, вследствие образования реакционноспособного промежуточного соединения А+К=АК, которое взаимодействует с другим исходным веществом В с образованием продукта реакции АВ и выделением катализатора К в первоначальном виде АК+В=АВ+К.
Примером гомогенного катализа может служить окисление диоксида серы в серную кислоту при использовании в качестве катализатора NO2:
2SО2+О2+2Н2О=2Н2SО4.
Эта реакция лежит в основе одного из промышленных методов получения серной кислоты.
Химическое равновесие. Константа химического равновесия.
Реакции, которые при заданных условиях протекают одновременно в двух взаимопротивоположных направлениях, называются обратимыми и обозначаются mА+nВ↔рС+dD. Согласно закону действия масс, скорости прямой и обратной реакций соответственно равны: ύ1 =k1 [A]m[B]n, ύ2 =k2 [C]p[D]d
При достижении равновесия скорость прямого процесса становится равной скорости обратного: ύ= ύ2. Следовательно, k1 [A]m[B]n = k2 [C]p[D]d, обозначив Kp=k1/k2, получим:
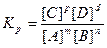 , где Кр - константа равновесия.
, где Кр - константа равновесия.
Значение величины Кр дает возможность судить о преимуществе того или иного процесса. Для гетерогенных реакций в выражение для константы равновесия входят концентрации только тех веществ, которые находятся только в газовой или жидкой фазах. Например, для реакции СО2(г)+С(тв)↔2СО(г) КР=[СО]2/[СО]. Константа равновесия зависит только от температуры и природы реагентов.
Изменение энергии Гиббса ΔG обратимого процесса связано с константой химического равновесия следующим уравнением: ΔG = –RТ1nКр. Здесь R - универсальная газовая постоянная, Т- абсолютная температура.
Эта зависимость позволяет, зная ΔG, вычислить константу равновесия и равновесные концентрации реагирующих веществ. Переходя к десятичному логарифму и подставляя значение R, уравнение принимает вид ΔG =-5,71lgКР, кДж/моль.
В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями). Они обозначаются так же, но с индексом р: [СО2]Р, [СО]Р.
Принцип Ле-Шателье.
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций, и минимальному значению энергии Гиббса, является наиболее устойчивым состоянием системы при заданных условиях, и остается неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось. При изменении условий равновесие нарушается и смещается в ту или иную сторону. Направленные смещения равновесия определяются принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Смещение равновесия может быть вызвано изменением температуры, давления, концентрации одного (или нескольких) реагента.
При повышении температуры увеличивается константа равновесия эндотермического процесса (ΔН>0). Это значит, что при повышении температуры равновесие смещается вправо, в сторону прямой реакции, идущей с поглощением теплоты. Константа равновесия экзотермического процесса (ΔН<0) при повышении температуры уменьшается. Это значит, что при повышении температуры равновесие экзотермической реакции смещается влево.
Смещение равновесия может быть вызвано изменением концентрации одного из компонентов: добавлением вещества в равновесную систему или выводом его из системы. Согласно принципу Ле-Шателье, при увеличении концентрации одного из исходных веществ равновесие смещается в правую сторону, а при увеличении концентрации одного из продуктов реакции - в левую.
Если в обратимой реакции участвует хотя бы одно газообразное вещество, смещение равновесие может быть вызвано изменением давления. Повышение давления при постоянной температуре равносильно сжатию газа, то есть увеличению его концентрации. При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действия масс возрастает, что приводит к смещению равновесия в направлении уменьшения концентрации газообразного компонента. При понижении давления при постоянной температуре газ расширяется, и его концентрация в системе падает. Это вызывает уменьшение скорости реакции, равновесие смещается в направлении увеличения давления газа. Например, при увеличении давления в системе СаСОз ↔ СаО+СO2 возрастает скорость обратной реакции ύ = k2[СО2], что приводит к смещению равновесия в левую сторону. При понижении давления на ту же систему скорость обратной реакции уменьшается, это приводит к смещению равновесия в правую сторону. В системе 2НС1↔Н2+Cl2 все вещества газообразные, при изменении давления смещения не произойдет, так как обе скорости возрастут одинаково.
Итак, в соответствии с принципом Ле-Шателье при повышении давления равновесие смещается в сторону образования меньшего числа молей газообразных веществ и соответственно в сторону уменьшения давления в системе. Наоборот, при внешнем воздействии, вызывающим понижение давления, равновесие смещается в сторону образования большего числа молей газа, что противодействует внешнему воздействию и вызывает увеличение давления в системе.
Тема: «Растворы. Растворы неэлектролитов»
План
1. Общая характеристика растворов. Растворимость
2. Способы выражения концентрации растворов
3. Общие свойства растворов. Законы Рауля и Вант-Гоффа.
Растворение - сложный физико-химический процесс. В зависимости от природы растворенного вещества и растворителя преобладает либо физическая, либо химическая сторона явления. Физическая - статистическое распределение растворенного вещества (разрушение кристаллической решетки, процесс эндотермический, ΔН1>0). Химическая - гидратация образующихся частиц, процесс экзотермический, ΔН2<0. Знак суммарного процесса растворения определяется соотношением величин ΔН1 и ΔН2.
Очень многие химические реакции, в том числе технические и жизненно важные, протекают в жидких растворах. Растворами называют гомогенные смеси переменного состава, находящиеся в состоянии химического равновесия. Растворы - это как минимум двухкомпонентные системы. Растворитель сохраняет свое фазовое состояние при образовании раствора. Его концентрация по определению выше, чем концентрации других компонентов.
Многие свойства растворов зависят от их концентрации. Концентрацией называется отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы.
Молярная концентрация вещества В Св – отношение количества вещества (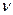 , моль) к объему системы (V, л):
, моль) к объему системы (V, л): 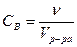 моль/л или моль/м3.
моль/л или моль/м3.
Молярная доля вещества В (хв) - отношение количества вещества (моль), содержащегося в системе, к общему количества вещества (моль). Молярная доля может быть выражена в долях единицы и в процентах.
Объемная доля вещества В (φв) - отношение объема компонента, содержащегося в системе, к общему объему системы. Объемная доля может быть выражена в долях единицы и в процентах.
Массовая доля вещества В (ωв) - отношение массы данного компонента к общей массе этой системы. Может быть выражена в долях единицы и в процентах.
Растворимость. При растворении веществ возникает равновесие, при котором скорость растворения фазы равна скорости ее образования.
Растворенное вещество (фаза) ↔ раствор
При равновесии изменение энергии Гиббса равно нулю. Раствор, в котором устанавливается равновесие между растворением и образованием (осаждением, кристаллизацией, выделением вещества), называется насыщенным, а концентрация такого раствора — растворимостью. Растворимость газов уменьшается с увеличением температуры. Растворимость твердых веществ может как увеличиваться, так и уменьшаться, а также мало зависеть от температуры.
Растворимость вещества зависит от свойств растворителя. Вещества с одинаковым характером связей имеют большую тенденцию к взаимной растворимости - подобное растворяется в подобном. Например, полярные и ионные вещества хорошо растворимы в полярных растворителях, неполярные - в неполярных растворителях.
Общие свойства растворов - те свойства, которые не зависят от природы растворенных веществ, а только от их концентрации. Они также называются коллигативными. Такие свойства характерны для идеальных растворов.
Идеальным называют раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Энтальпия образования такого раствора равна нулю, каждый компонент является независимым от других. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы.
К общим свойствам растворов относят понижение давления насыщенного пара растворителя над раствором и температуры замерзания, повышение температуры кипения и осмотическое давление. Растворенным веществом в таких растворах является нелетучее вещество, давлением пара которого можно пренебречь.
Закон Рауля. Понижение давления насыщенного пара растворителя А над раствором ΔрА пропорционально молярной доле растворенного нелетучего вещества
хв: р°А – рА = Δр а = р°А хВ,
где р°а, ра - давления насыщенного пара растворителя соответственно над чистым растворителем и раствором. Из уравнения видно, что с увеличением содержания нелетучего растворенного вещества давление пара растворителя над раствором уменьшается, то есть р°а>ра.
Из закона Рауля следует:
1. Температура кипения раствора выше температуры кипения растворителя, потому что давление насыщенного пара растворителя над раствором становится равным атмосферному (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Повышение температуры кипения пропорционально моляльности раствора:
ΔТкип=КэСm.
Здесь Кэ - эбуллиоскопическая константа растворителя.
2. Температура замерзания (кристаллизации) раствора ниже температуры замерзания чистого растворителя, потому что давление пара растворителя над раствором ниже, чем над растворителем. Понижение температуры замерзания пропорционально моляльности раствора:
ΔТ3ам=КкСm.
Здесь Кк - криоскопическая константа.
Значения эбуллиоскопической и криоскопической констант зависят от природы растворителя; для воды они составляют соответственно 0,52 и 1, 85 кг·К/моль.
Используя следствие из закона Рауля, можно определить молярную массу вещества. Для этого экспериментально определяют изменение температуры кипения или замерзания раствора. Зная массу растворенного вещества mв, его молярную массу находят по уравнению:
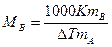 ,
,
где К - либо эбулио-, либо криоскопическая константы.
Закон Вант-Гоффа. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель, либо два раствора с различной концентрацией растворенного вещества, называется осмосом. Перегородка пропускает только молекулы растворителя, которые переходят из раствора с меньшей концентрацией в более концентрированный раствор. Концентрированный раствор разбавляется и увеличивается высота его столба. Количественно осмос характеризуют осмотическим давлением, равным силе, приходящейся на единицу площади поверхности и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предложил для осмотического давления применить уравнение состояния идеального газа pV=nRТ, или p=nRТ/V. Отсюда
p=СRТ - осмотическое давление.
С -молярная концентрация раствора.
Осмос играет важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называются изотоническими; если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, ниже -гипотоническим. Среднее осмотическое давление крови при 36°С равно 78 кПа. Гипертонические растворы, например, соли и сахара (рассол), широко применяют для консервирования овощей (огурцов), так как они вызывают удаление воды из микроорганизмов. Огурцы в крепком рассоле сморщиваются, в гипотоническом растворе - разбухают.
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов, являющихся моделью идеальных растворов, в реальных растворах вместо концентрации используется активность, о которой подробно будет сказано в следующей лекции.
Тема: «Растворы электролитов»
План
1. Растворы электролитов. Основные положения теории электролитической диссоциации.
2. Степень электролитической диссоциации.
3. Сильные и слабые электролиты. Константа диссоциации.
4. Активность электролитов. Применение законов Рауля и Вант-Гоффа к растворам электролитов.
5. Диссоциация воды. Ионное произведение воды. Водородный показатель.
6. Ионно-молекулярные реакции в растворах. Произведение растворимости.
7. Реакции нейтрализации и гидролиз солей.
Общие свойства растворов электролитов
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Свойства электролитов были рассмотрены и обобщены в трудах Аррениуса, развиты в трудах И.А. Каблукова, В.А. Кистяковского, на основе гидратной теории растворения Д.И. Менделеева. Основные положения теории электролитической диссоциации (ионизации):
1. При растворении солей, кислот и оснований в воде происходит диссоциация (ионизация) этих соединений с образованием электрически заряженных частиц -катионов и анионов.
2. Электрическая проводимость растворов солей, кислот и оснований в воде прямо пропорциональна общей концентрации ионов в растворе.
Уравнение электролитической диссоциации можно записать, опустив промежуточные стадии, указав лишь начальные и конечные продукты реакции:
АВ+(n+m)Н2О ↔ АР+nН<