ХИМИЯ 27.04.2020 Следующий урок в четверг 30.04.2020г
Домашнее задание.
Внимание!!! На следующем уроке будет контрольная работа. Пробный вариант контрольной расположен ниже практической работы. Если у вас есть вопросы, вы можете их задать в ВК до четверга.
Выполните практическую работу в рабочей тетради.
Решение пришлите не позднее 14.45 как фото в контакте.
Двадцать седьмое апреля
Практическая работа № 4
Получение, сбор и качественное определение газов.
Цель: закрепить навыки получения газов в лаборатории, способы их сбора; повторить методы распознания газов в лаборатории.
Ход работы:
Опыт 1. Получение водорода и сбор его методом вытеснения воды.
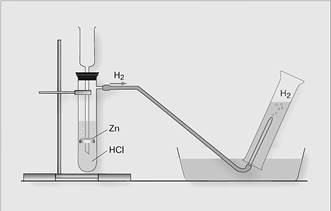 В прибор для получения газов опустите гранулы цинка. Налейте соляной кислоты (столько, чтобы кислота лишь покрывала цинк). Пронаблюдайте за происходящим в приборе.
В прибор для получения газов опустите гранулы цинка. Налейте соляной кислоты (столько, чтобы кислота лишь покрывала цинк). Пронаблюдайте за происходящим в приборе.
Заполните чистую пробирку водой. Отверстие пробирки закройте большим пальцем, переверните ее и опустите в кристаллизатор с водой. Уберите палец от отверстия.
В пробирку с водой аккуратно заведите газоотводную трубку от прибора. Соберите в пробирку водород и проверьте его на чистоту.
Внимание! Горелка должна быть расположена от прибора на расстоянии 0,5 м! Положение пробирки-приемника при подносе к пламени горелки не изменяйте.
Вопросы:
1. Напишите уравнение получения водорода в лаборатории, составьте к нему электронный баланс. Опишите наблюдения.
2. Почему водород можно собирать методом вытеснения воды?
3. Почему нельзя располагать горелку рядом с прибором для получения водорода? Ответ сопроводите уравнением реакции.
4. Как понять, что собранный водород чист?
Опыт 2. Получение кислорода из перманганата калия и сбор его методом вытеснения воздуха.
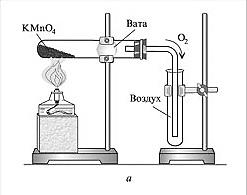
В сухую пробирку поместите 2 г перманганата калия. У отверстия пробирки разместите кусочек ваты и закройте пробирку пробкой с газоотводной трубкой. Проверьте прибор на герметичность.
Закрепите пробирку в штативе, как показано на рисунке. Газоотводную трубку опустите в колбу для сбора кислорода.
Перед нагреванием кристаллов перманганата калия прогрейте всю пробирку, затем нагревайте только кристаллы. Через некоторое время после начала реакции разложения проверьте наличие кислорода в колбе с помощью тлеющей лучинки. (Внимание! Не вносите тлеющую лучинку в колбу. Подносите ее только к отверстию колбы.)
После того, как вы получите полную колбу кислорода, остановите нагревание.
Вопросы:
1. Напишите уравнение получения кислорода из перманганата калия, составьте к нему электронный баланс. Опишите наблюдения.
2. Как проверить наличие кислорода в колбе?
3. На каких свойствах кислорода основан сбор газа методом вытеснения воздуха?
Опыт 3. Получение углекислого газа, его качественное определение.
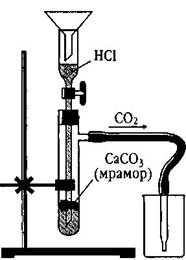 В прибор для получения газов поместите кусочки мела и закройте его. Через верхнюю воронку приливайте раствор соляной кислоты так, чтобы весь мел был погружен в жидкость. В то же время не добавляйте соляную кислоту сразу большими порциями, так как реакция протекает очень бурно.
В прибор для получения газов поместите кусочки мела и закройте его. Через верхнюю воронку приливайте раствор соляной кислоты так, чтобы весь мел был погружен в жидкость. В то же время не добавляйте соляную кислоту сразу большими порциями, так как реакция протекает очень бурно.
Газоотводную трубку опустите в пробирку с раствором известковой воды.
Вопросы:
- Напишите молекулярное и ионные уравнения получения углекислого газа.
- Объясните, почему при пропускании углекислого газа через раствор известковой воды сначала происходит помутнение раствора, а затем взвесь растворяется? Объяснение сопроводите соответствующими молекулярными и ионными уравнениями реакций.
- Почему раствор известковой воды является качественным реактивом на углекислый газ?
Вывод:
1. Какими методами собирают газы в лаборатории? На чем основан выбор метода сбора газа?
2. Для чего необходимо качественное определение газов? Каким условиям должны отвечать качественные реакции для определения веществ?
*Пробный вариант контрольной работы.
- Изобразите строение атома азота. Покажите его валентные возможности, укажите возможную степень окисления.
- Составьте уравнения реакций взаимодействия и электронные балансы для:
а) серы с натрием; б) горения аммиака в кислороде
в) концентрированной азотной кислоты с железом.
- Осуществите превращение, где возможно напишите ионные уравнения:
H2SO4→ FeSO4 → Fe(OH)2 → FeO → FeCl2
- Какая масса оксида кремния(IV) должна образоваться при горении 60г кремния, содержащего 5% примесей?
.