ИОНОМЕТРИЯ
Иоиометрия – это прямой потенциометрический метод определения активности или концентрации ионов в растворе путем измерения потенциала ионселективного электрода, погруженного в раствор.
Ионселективный электрод – это электрохимический полуэлемент, у которого на границе раздела фаз раствор электролита – электродный материал возникает потенциал, зависящий от активности определяемого иона, a i. Ионной селективностью (избирательностью) обладают почти все типы электродов. Так, электроды I рода селективны к катионам металла, из которого изготовлен электрод, II рода – к анионам труднорастворимого соединения, которым покрыт металл. Широкие возможности в ионометрии имеют мембранные электроды: стеклянные, кристаллические твердые, жидкие, пластифицированные – у которых потенциалопределяющим является процесс обмена подвижных ионов между электролитом и электродом, обладающим ионной электропроводностью.
Определение активности и концентрации фторид – ионов
Цель настоящей торной работы состоит в изучении теоретических основ ионометрии на примере исследования электродной характеристики лантанфторидного электрода и в ознакомлении с методами определения концентрации и активности фторид-иона в растворах.
Фторидселективный мембранный электрод изготовляется из монокристалла фторида лантана, легированного для повышения электроводности фторидом европия (II) (0,5 %). В гексагональной решетке фторида лантана ион La3+ окружен пятью ионами F-, причем следующими шестью ближайшими соседями La3+ также являются F--ионы. В результате решетка состоит из чередующихся слоев LaF2+ и F-. Обладая малым размером, F--ионы относительно подвижны, благодаря чему кристаллы фторида лантана имеют свойство твердого электролита. Перенос заряда в них описывается следущей схемой:
LaF3+ молекулярная дырка → LaF2+ + F-.
Внешний слой кристалла обменивается фторид-ионами с раствором. Малый размер фторид-ионов обусловливает высокую селективность электрода. Только близкие по размеру ионы OH- оказывают сильное мешающее влияние. Об этом же свидетельствуют значения произведений растворимости: свежеосажденного фторида лантана 10-17,9, монокристалла фторида лантана 10-24,5 и гидроксида лантана 10-18,7. Мешают определению и катионы, которые связывают фторид-ионы в малодиссоциированные соединения. Например, в присутствии ионов H+ образуются ионы [HF2]-. Поэтому рабочая область рН лантанфторидного электрода ограничена – 4,5 - 8,0.
Для измерений содержания фторид–ионов в растворе собирают гальванический элемент из индикаторного ионселективного электрода и хлоридсеребряного электрода сравнения:
Ag│AgCl,0,1MNaF,KCl(насыщ)│LaF3│Исследуемый раствор││KCl(насыщ),AgCl│Ag+
Индикаторный ионселективный Хлоридсеребряный
лантанфторидный электрод электрод сравнения
Его электродвижущая сила (ЭДС) подчиняется уравнению Нернста:
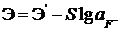 , (10)
, (10)
где 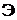 – ЭДС электродной измерительной цепи;
– ЭДС электродной измерительной цепи; 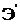 – ЭДС электродной измерительной цепи при активности фторид-ионов
– ЭДС электродной измерительной цепи при активности фторид-ионов 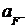 = 1;
= 1; 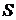 – крутизна электродной характеристики, теоретически определяемая как
– крутизна электродной характеристики, теоретически определяемая как 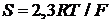 и равная 0,0591 В при 25 °С.
и равная 0,0591 В при 25 °С.
Основываясь на уравнении (10), можно по стандартным растворам либо построить градуировочную зависимость 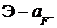 или
или 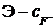 , либо соответственно настроить и отградуировать измерительный прибор – иономер, а затем по измеренному значению ЭДС ячейки с испытуемым раствором найти активность
, либо соответственно настроить и отградуировать измерительный прибор – иономер, а затем по измеренному значению ЭДС ячейки с испытуемым раствором найти активность 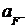 или концентрацию
или концентрацию 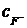 определяемых ионов.
определяемых ионов.
Особенности градуировки в ионометрии
Наиболее общим методом градуирования в ионометрии является построение градуировочной зависимости с использованием стандартных растворов. При этом иономер работает в режиме милливольтметра. Типичный вид градуировочной зависимости показан на рис. 2.
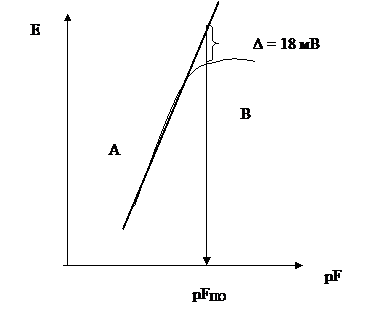
Рис. 2. Типичный вид градуировочной зависимости
Линейный участок А характеризуют значением крутизны S. Загиб кривой в области малых содержаний определяемого иона (участок В) обычно связывают с конечной растворимостью мембран, влиянием мешающих ионов и пр. Эти же факторы ограничивают и предел обнаружения ионометрии с твердыми ионселективными электродами. В соответствии с рекомендациями IUPAC (международный союз теоретической и прикладной химии) пределом обнаружения (ПО) при использовании ионселективных электродов считается такая концентрация или активность иона, при которой отклонение ∆ от линейной зависимости становится 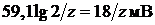 (
(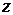 – заряд иона).
– заряд иона).
При подготовке стандартных растворов для градуировки необходимо заранее определить, какая величина представляет интерес дня исследователя: активность иона, важная, например, при изучении равновесий, кинетики и т.д., или концентрация, обычно определяемая в аналитических измерениях.
При определении активности ионов в растворе, если в нем нет мешающих (изменяющих потенциал электрода) ионов, состав его не играет никакой роли, т.е. измерению активности не мешают высокий солевой фон сильных электролитов, наличие комплексообразователей или осадителей, природа растворителя. Основная трудность градуировки связана с приготовлением стандартных растворов, т.к. для этого необходимо точно знать не только концентрацию, но и коэффициент активности определяемого иона (f).
Все методы вычисления коэффициентов активности являются приближенными, и поэтому чаще значения f определяют экспериментально. Если данных о коэффициентах активности определяемого иона нет вообще, то градуировочную кривую, полученную с разбавленными растворами (менее 10-3 М; f ≈ 1), можно продолжить в сторону более высоких концентраций. Хотя для точной работы этот прием экстраполяции рекомендовать нельзя, тем не менее некоторые коэффициенты активности в растворах выше 0,1 М были получены именно таким образом.
Часто для градуировки ионселективных электродов в их паспорте указывают сведения о коэффициентах активности ионов в стандартных растворах. Данные, необходимые при работе с лантанфторидным электродом, приведены в таблице.
Данные об активности F-- ионов в растворах фторида натрия различной концентрации
| Величина | Значения величины для концентрации NaF, М | ||||
| 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | |
| f | 0,758 | 0,899 | 0,964 | 0,986 | 1,0 |
| pF | 1,122 | 2,046 | 3,016 | 4,005 | 5,00 |
Для определения концентрации иона необходимо, чтобы коэффициенты активности в стандартных и анализируемом растворах были одинаковы. Такое возможно в растворах с одинаковой ионной силой. Например, если необходимо получить относительную погрешность определения ±2 % для однозарядных ионов и ±5 % для двухзарядных ионов, то необходимо, чтобы стандартные и анализируемый растворы отличались друг от друга по ионной силе не более чем в 5 раз при концентрации определяемого иона 10-3 М, на ±50 % – в пределах 10-3–10-2М и на ±20 %–в пределах 10-2 –10-1 М.
Наиболее распространенный способ согласования ионной силы исследуемого и стандартного растворов заключается в добавлении индифферентного электролита, при помощи которого во всех растворах устанавливают такую высокую ионную силу, что различием ионной силы отдельных анализируемых растворов можно пренебречь. Например, в качестве индиферентных электролитов часто применяют растворы: 5 М NaNO3, буферный раствор (1 M NH4Cl + 1 M NH3∙H2O), 1 M Na2SO4, 1 M раствор цитрата аммония и др.
При использовании лантанфторидного электрода необходимо обеспечить не только постоянную ионную силу растворов, но и определенное значение рН. Поэтому в качестве индиферентного раствора используют ацетатный буферный раствор (2 М НАс + 2 М NаАс) с рН 4,75. Если в анализируемом растворе присутствуют ионы, способные образовывать со фторид-ионом прочные комплексные соединения или осадки (Fe3+, Al3+ и др.), то для их маскирования в растворы добавляют цитрат-ионы, образующие с металлами более прочные комплексные ионы.
Если в исследуемой области содержаний или активности иона электродная функция линейна и подчиняется уравнению (10), то шкала иономера может быть непосредственно оцифрована в единицах рХ. Наиболее часто такую градуировку прибора осуществляют путем фиксации двух точек линейной зависимости с помощью двух стандартных растворов с известными значениями рХ.