Поверхностное натяжение на границе «жидкость – жидкость» зависит от природы соприкасающихся фаз: чем больше разница полярности фаз, тем больше величина поверхностного натяжения на границе их раздела.
Поверхностное натяжение на границе «жидкость – газ» мера гетерогенной системы. При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности, а также уменьшается поверхностное натяжение.
Адсорбция, основные термины (адсорбент, адсорбтив, адсорбат, десорбция)
Адсорбция – самопроизвольное изменение концентрации компонента, в поверхностном слое по сравнению с его концентрацией в объёме. Адсорбент - вещество, на котором адсорбируются молекулы других веществ Адсорбтив - вещество, молекулы которого адсорбируются на адсорбенте; Адсорбат – молекулы вещества которые уже адсорбировалось на адсорбенте. Десорбция - процесс, обратный адсорбции.
Деление адсорбции в зависимости от природы действующих сил на химическую и физическую.
Физическая адсорбция обусловлена межмолекулярным взаимодействием за счёт сил Ван-дер-Ваальса или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность.
Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Химическая адсорбция: необратима, специфична и локализована
Уравнение адсорбции Гиббса, его анализ. Поверхностно-активные, поверхностно-инактивные и поверхностно-неактивные вещества. Изотерма адсорбции, предельная адсорбция Г.
Г= -  *
* 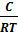
с - молярная концентрация растворённого вещества в растворе.
Г – поверхностная адсорбция.
Т – температура, при которой происходит адсорбция.
R – газовая постоянная.
 – изменение поверхностного натяжения раствора при изменении концентрации на 𝞓С.
– изменение поверхностного натяжения раствора при изменении концентрации на 𝞓С.
1. Если Г › 0, т.е. концентрация растворенного вещества в поверхностном слое больше, чем в объёме раствора, то  ‹ 0. Это характерно для ПАВ. Важнейшие ПАВ – водоростворимые органические соединения, молекулы которых состоят из двух частей: полярной (гидрофильной) и неполярной (гидрофобной). Если в данном растворителе полярная часть диссоциирует, то ПАВ называется ионогенным, в противном случае – неионогенным.
‹ 0. Это характерно для ПАВ. Важнейшие ПАВ – водоростворимые органические соединения, молекулы которых состоят из двух частей: полярной (гидрофильной) и неполярной (гидрофобной). Если в данном растворителе полярная часть диссоциирует, то ПАВ называется ионогенным, в противном случае – неионогенным.
2. При добавлении веществ более полярных, чем растворитель (ПИВ), поверхностное натяжение увеличивается, а Г ‹ 0. Ионы этих соединений взаимодействуют сильнее с молекулами воды, чем молекулы воды друг с другом. Поэтому значительная часть ионов увлекается внутрь объема раствора. Оставшиеся на поверхности ионы создают силовое поле, тем самым повышая поверхностное натяжение.
3. Есть вещества, которые не изменяют поверхностное натяжение Г=0.Их называют (ПНВ).

Из графика следует, что по мере увеличения концентрации вещества адсорбция возрастает вначале резко, а затем всё медленнее и медленние, приближаясь к некоторой величине предельной адсорбции Г∞. Поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна, дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.