Диффузиейназывают самопроизвольный процесс выравнивания концентрации частиц по всему объему раствора или газа под влиянием броуновского движения. Процесс диффузии идет самопроизвольно, поскольку он сопровождается увеличением энтропии системы. Равномерное распределение вещества в системе отвечает наиболее вероятному ее состоянию.Часто за причину диффузии принимают осмотическое давление. Это представление было развито Нернстом (1885 г.). Так как осмотическое давление может проявляться лишь при наличии полунепроницаемой перегородки, то это давление бессмысленно рассматривать как какую-то реальную силу, существующую вне связи с мембраной. Тем не менее, осмотическое давление, являющееся также результатом хаотического движения молекул, иногда удобно принимать за причину диффузии. Перенос массы в результате диффузии сходен с закономерностями переноса тепла или электричества – это легло в основу первого закона диффузии (Фик, 1855г.).
ФИКА ЗАКОНЫ, законы диффузии в идеальных растворах при отсутствии внешних воздействий. 1-й закон Фика устанавливает пропорциональность диффузионного потока частиц градиенту их концентрации; 2-й закон Фика описывает изменение концентрации, обусловленное диффузией.
ФИКА ЗАКОНЫ - осн. феноменологич. законы диффузии. Сформулированы в 1855 А. Фиком (A. Pick) по аналогии с теплопроводности уравнением. Первый Ф. з. устанавливает для стационарной диффузии пропорциональность плотности потока j диффундирующих частиц градиенту их концентрации с: 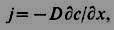
где D - коэф. диффузии, х - координата. Второй Ф. з. описывает нестационарный случай, он следует из первого Ф. з. при учёте изменения концентрации диффундирующих частиц со временем t:
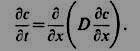
При D = const второй Ф. з. представляет собой ур-ние диффузии: 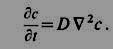
45. Осмотическое давление в коллоидных системах. Процесс самопроизвольного перехода растворителя через полупроницаемую перегородку из той части системы, где концентрация растворенного вещества ниже в другую, где концентрация выше, это явление называется осмосом. При достижении некоторого давления со стороны раствора наступает подвижное равновесие, скорость диффузии воды будет уравновешено со скоростью обратного перехода. Давление, которое нужно приложить к раствору, чтобы прекратить осмос, то есть проникновение в него через полупроницаемую перегородку чистого растворителя, называется осмотическим давлением. Осмотическое давление является мерой стремления раствора вещества следует тепловое движение молекул переходит в процесс диффузий из раствора в чистый растворитель и равномерно распределяется по всему общему растворителю.
Вант Гофф установил закон согласно которому осмотическое давление раствора равно тому давлению, которое произвело бы растворенное вещество и если бы оно при той же температуре находилось в газообразном состоянии и занимало объем равный общему раствору.
В истинных растворах, отделенных от растворителя полупроницаемой перегородкой, может быть измерено осмотическое давление, величина которого зависит от концентрации растворенного вещества и для разбавленных растворов описывается уравнением Вант Гоффа
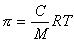 , (2.2.96)
, (2.2.96)
где С – массовая концентрация, кг/м3.
Для коллоидных систем можем записать
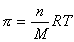 , (2.2.97),где n – частичная концентрация частиц/м3.
, (2.2.97),где n – частичная концентрация частиц/м3.
Грэм пытался определить осмотическое давление коллоидных растворов и пришел к ошибочному выводу, что коллоидные системы этим свойством не обладают. Как известно, именно на этом ошибочном факте Грэм провел разделение на истинные растворы и коллоидные системы.
Однако тот факт, что частицы в коллоидном состоянии также совершают хаотическое движение, не оставляет сомнений в том, что осмотическое давление должно быть и у коллоидных систем.
Еще одним молекулярно-кинетическим свойством является осмотическое давление.
Следовательно осмотическое давление зависит только от числа частиц в единице объема раствора и не зависит от природы и размера частиц. При одинаковой массовой концентрации частичная концентрация коллоидных растворов всегда меньше, чем у истинных, поэтому и осмотическое давление у них должно быть небольшим. Для двух коллоидных растворов с одинаковой массовой концентрацией, исходя из уравнения (62) можно написать: π1/ π2 = ν1/ ν2. Если принять, что коллоидные частицы имеют форму шара, то масса одной частицы равна: m = 4/3πr3ρ, где r – радиус частицы, а ρ – плотность вещества дисперсной фазы. Осмотическое давление обратно пропорционально кубу радиуса частиц дисперсной фазы. Этим объясняется не только малое осмотическое давление в коллоидных растворах, но и его непостоянство. В коллоидных растворах очень легко идут процессы агрегации/дезагрегации частиц, их размер увеличивается/уменьшается, соответственно изменяется и осмотическое давление.