Назначение стадии:
- ввести азот в систему, используя для доконверсии метана смесь окислителей водяного пара и кислорода воздуха;
- обеспечить стехиометрическое соотношение H2:N2 =3.
Процесс паровоздушной конверсии метана сопровождается следующими химическими реакциями:
CH4 + 0,5O2 = CO + 2H2 + Q (1)
CH4 + 2O2 = CO2 + 2H2O + Q (2)
CH4 + H2O = CO + 3H2 − Q (3)
H2 + 0,5O2 = H2O + Q (4)
CH4 + CO2 = 2CO + 2H2 − Q (5)
В начале реакционной зоны в газовой смеси присутствует свободный кислород и преобладают экзотермические реакции (1, 2, 4). В результате протекания этих реакций резко повышается температура и создаются благоприятные условия, при которых непрореагировавший метан вступает во взаимодействие с водяным паром и диоксидом углерода по эндотермическим реакциям (3, 5), что позволяет вести паровоздушную конверсию автотермично.
С увеличением температуры константа равновесия реакции (1) уменьшается, но ее численные значения свидетельствуют о необратимости рассматриваемой реакции.
| T, 0С | |||
| Кр | 3,05∙1011 | 1,96∙1011 | 1,425∙1011 |
Состав конечных продуктов конверсии зависит от соотношения О2:СН4. При небольшой концентрации кислорода в исходной смеси (12%), повышенном давлении продуктами неполного окисления является метанол, формальдегид, муравьиная кислота и др. При увеличении содержания кислорода в смеси до 35% окисление метана протекает по реакциям (1, 2). Дальнейшее увеличение содержания кислорода в смеси увеличивает количество диоксида углерода и снижает концентрацию монооксида углерода и водорода (реакции 1, 5).
Для получения азото-водородной смеси стехиометрического состава к 1м3 конвертируемого метана необходимо добавить 1,14м3 воздуха, что эквивалентно 0,9м3 азота. При этом расход технического кислорода снижается на 32%.
Таким образом, согласно термодинамическому анализу, степень конверсии метана водяным паром тем выше, чем ниже температура, выше давление и меньше избыток водяного пара. Разбавление газовой смеси азотом эквивалентно понижению давления.
В промышленных условиях конверсию метана можно проводить в гомогенных условиях при температуре 1400 - 1500°С. В этих условиях окисление протекает по цепному механизму. Скорость такого процесса будет зависеть от устойчивости промежуточных соединений. Причем, с увеличением степени окисления скорость реакции возрастает. Замедлить реакцию на нужной стадии не представляется возможным. Поэтому в ходе гомогенного окисления метана под атмосферным давлением получают газовую смесь, содержащую, в основном, диоксид углерода.
Недостаток данного способа конверсии метана – значительное сажевыделение.
Наибольшее распространение получил метод конверсии метана смесью окислителей с использованием катализатора. В промышленных условиях для доконверсии метана используют катализаторы следующих марок:
- никелевые – ГИАП-3-6н; ГИАП-8;
- марганец – кобальтовые (состава, %: 2 - 3,5Mn; 6 - 8 Co + добавки Са,Мg)
Предпочтение отдано никелевому катализатору, который обладает:
- селективностью по отношению к реакции (1,4), то есть ускоряет процесс взаимодействия метана с окислителями;
- защищает продукты реакции от их дальнейшего окисления.
Активность никелевого катализатора определяется остаточным содержанием метана в сухом конвертируемом газе при стандартных условиях испытаний для частиц катализатора с размером 2-3 мм.
Характеристика катализатора ГИАП -3-6н:
содержание никеля, % масс. 4 -10.
размер гранул, мм. 8-20
уд. поверхность, м2/г 4 -40
Механизм процесса доконверсии метана смесью окислителей является гетерогенно-гомогенным. Процесс начинается взаимодействием СH4 с адсорбированным на поверхности катализатора кислородом и выделением в газовую фазу метильного радикала CH3*. Процесс включает следующие стадии:
O2 = O* + O* (1)
O* + CH4 = CH*3 + OH* (2)
2CH*3 = C2H6 (3)
CH3* + O2 = CH3O*2 (4)
2CH3O2* = CO + CO2 + H2 (5)
CH*3 + CH3O*2 = CO + CO2 + H2O (6)
При повышении температуры или уменьшением концентрации кислорода равновесие реакции (2) смещается в сторону исходных веществ и конечным продуктом окисления является этан С2Н6.
Увеличение концентрации кислорода смещает равновесие стадии (2) вправо и продуктами реакции являются СO, CO2, H2O.
С учетом данного механизма, скорость процесса может быть рассчитана по следующему кинетическому уравнению:
r = k·CH4·CO2
Дальнейшие исследования механизма паровоздушной конверсии позволили включить гетерогенные стадии.
Обозначим через Z - активный центр поверхности катализатора.
O2 + 2Z → 2ZO (1)
CH4 + ZO → ZCH3OH (2)
ZCH3OH + ZO →ZHCHO + H2O + Z (3)
ZYCOH + ZO →ZZHCOOH (4)
ZZHCOOH + ZO →CO2 + H2 + 3Z (5)
ZCH3OH →CH3 + ZOH (6)
2CH3 →C2H6 (7)
2ZOH →H2O + Z (8)
Согласно механизму, процесс конверсии начинается взаимодействием СН4 с окисленной поверхностью катализатора.
Лимитирующей является стадия (2), которая характеризует взаимодействие молекул СН4 с активным центром катализатора - ZO.
Исходя из данного механизма, для расчета скорости конверсии предложено следующее кинетическое уравнение:
r = k*PCH4 |ZO|
Скорость конверсии метана смесью окислителей зависит от парциального давления PСН4 в газовой фазе и концентрации покрытых кислородом активных центров катализатора.
Состав конечных продуктов конверсии будет определяться энергией разрыва связи в комплексе Z-O.Предельное значение энергии связи, по данным Борескова, составляет 250кдж/моль. При низкой энергии связи кислорода с поверхностью катализатора в системе протекает глубокое окисление метана и продуктами взаимодействия являются CO2, H2O.
При большем значении энергии связи (>250 кдж/моль) – конечные продукты взаимодействия – СO и H2.
На основании теоретических исследований при проведении процесса конверсии метана в присутствии никелевого катализатора необходимо строго поддерживать оптимальное соотношение О2/СН4 (при избытке кислорода в исходной смеси конечными продуктами конверсии являются СО2, Н2О; при недостатке кислорода – элементарный углерод).
В промышленных условиях, при проведении процесса под давлением на катализаторе ГИАП-16, большое значение имеет внутренняя диффузия. Для этих условий было рекомендовано следующее эмпирическое кинетическое уравнение:
r = К1·PCH4/РН20,75·[1 – 1/Кр · РСО·РН23/(РСН4·РН2О)]
где К1 = 2,03·106exp(-90850/RT)
Оптимальные параметры данной стадии: Твход: 700-800°С; Т в верхней зоне 1200°С, Твых: 1000°С; содержание СН4 на входе в аппарат 9-10%, на выходе 0,35-0,55%.
Задание на самостоятельное изучение: ознакомиться с конструкциями основных аппаратов, используемых для паровой и паровоздушной конверсии метана; ознакомиться с принципиальными технологическими схемами получения технологического газа для синтеза аммиака (стадии конверсии метана).
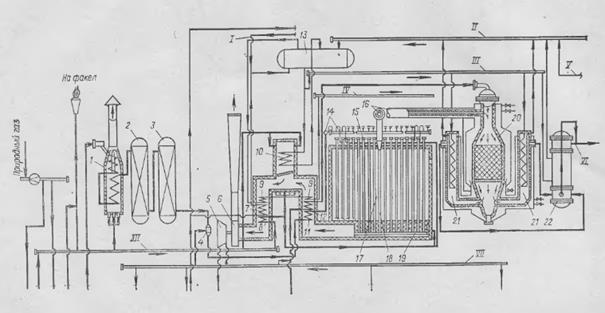
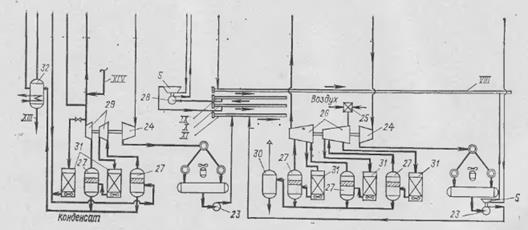
Рис. 4. Принципиальная энерготехнологическая схема производства технологического газа под давлением 30·105 Па в агрегате синтеза аммиака мощностью 1360 т/сут.: I – питательная деаэрированная вода; II – насыщенный водяной пар; III – питательная вода; IV – пар к турбине отделения синтеза аммиака; V – пар от котла первой ступени конверсии СО; VI – газ на конверсию СО; VII – пар; VIII – пар; IX – вода питательная деаэрированная; X – пар; XI – паровой конденсат; XII – отопительный газ; XIII – сброс жидких углеводородов; XIV – азото-водородная смесь; 1 – огневой подогреватель; 2 – реактор гидрирования сернистых соединений; 3 – адсорбер; 4 – смеситель; 5 – турбины с противодавлением; 6 – дымосос; 7 – экономайзер; 8 – подогреватель отопительного газа; 9 – пароперегреватель; 10 – вспомогательный котел; 11 – подогреватель парогазовой смеси; 12 – подогреватель воздуха; 13 – паросборник; 14 – коллектор парогазовой смеси; 15 – реакционные трубы; 16 – общий верхний коллектор конвертированного газа; 17 – трубчатая печь; 18 – секционная труба для отвода конвертированного газа; 19 – нижний секционный коллектор; 20 – шахтный реактор; 21 – котел-утилизатор 1-ой ступени; 22 – котел-утилизатор 2-ой ступени; 23 – насосы парового конденсата; 24 – конденсационные турбины; 25 – воздушный фильтр; 26 – турбокомпрессор технологического воздуха; 27 – сепараторы; 28 – насосы питательной воды; 29 – газовый турбокомпрессор; 30 – отстойник; 31 – воздушные холодильники; 32 – дегазатор.