Лекция 7.
Производство азотной кислоты.
Азотная кислота по объемам производства занимает второе место, уступая только серной. Основными потребителями азотной кислоты и ее солей являются сельское хозяйство, производство синтетических красителей, производство взрывчатых веществ, при производстве комплексных минеральных удобрений и т.д.
Азотная кислота является сильной одноосновной кислотой. Существует в трех агрегатных состояниях. Чистая безводная азотная кислота малоустойчива, разлагается при обычной температуре с выделением оксидов азота.
Плотности водных растворов азотной кислоты различной концентрации при температуре 20°С представлены в таблице 1.
Таблица 1
Плотности водных растворов азотной кислоты при температуре 20°С.
| с, мас.% | ||||||
| ρ, кг/м3 |
При 0°С и 0,1013 МПа азотная кислота обладает следующими свойствами:
- относительная молекулярная масса: 63,016;
- плотность жидкой кислоты: 1549,2 кг/м3;
- вязкость жидкой кислоты: 1,105 кПа·с;
- давление насыщенного пара: 1886,5 Па;
- температура плавления: -41,6°С;
- температура кипения: 82,6°С.
Азотная кислота производится двух сортов: неконцентрированная (разбавленная или слабая) с концентрацией до 62% и концентрированная с концентрацией до 99%.
Существуют следующие основные способы производства азотной кислоты:
1. Взаимодействие природных солей азотной кислоты (в основном нитрата натрия) с серной кислотой. Данный способ описывается реакцией:
NaNO3 + H2SO4 → HNO3 + NaHSO4
Учитывая ограниченные количества природной натриевой селитры, а так же постоянно увеличивающиеся потребности в азотной кислоте, данный способ производства не может обеспечить потребностей промышленности. К тому же для получения концентрированной азотной кислоты (96-98 мас.%) необходимо сырье высокого качества (содержание селитры в руде должно быть на уровне 96%, а концентрация серной кислоты 95-97%).
2. Способ фиксации азота воздуха дуговым (высокотемпературным) способом. В результате чего образуется оксид азота NO, из которого в дальнейшем получается азотная кислота. Данный метод требует больших затрат энергии, и поэтому не получил широкого распространения.
3. Способ получения оксида азота путем окисления аммиака. Процесс получения азотной кислоты из аммиака разделяется на две стадии: окисление аммиака в окись азота и окисление NO в высшие оксиды с последующим их поглощением водой. Схему процесса можно описать следующими реакциями:
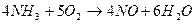
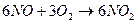
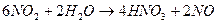
Данный способ получил название «Метод контактного окисления аммиака», который протекает в присутствии катализатора.
Контактное окисление аммиака.
В зависимости от условий проведения процесса окисления аммиака кислородом (при использовании катализаторов) возможно протекание следующих реакции:
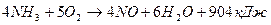 (1);
(1);
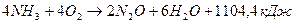 (2);
(2);
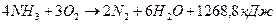 (3).
(3).
Одновременно возможно протекание и других реакций:
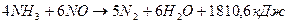 (4);
(4);
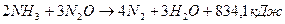 (5);
(5);
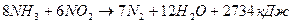 (6);
(6);
а также реакции диссоциации азота и аммиака:
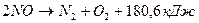 (7);
(7);
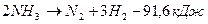 (8).
(8).
Константы равновесия основных реакций (1-3) можно записать в следующем виде:
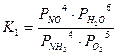 ;
; 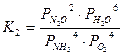 ;
; 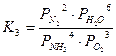 .
.
Термодинамические расчеты показали, что значения констант равновесия данных реакций имеют большое значение (при 900°С К1=1053; К2=1061; К3=1067), что свидетельствует о возможности протекания всех основных реакций с близким к 100% выходом продуктов.
Таким образом, процесс окисления аммиака может протекать в нескольких направлениях, состав конечных продуктов реакции определяется селективным действием катализатора и условиями проведения процесса.
Особенность катализатора избирательного действия заключается в том, что на нем происходит ускорение лишь одной из нескольких возможных реакций.
Катализаторы окисления аммиака.
При наличии большого числа побочных реакций катализатор, применяемый для окисления аммиака в производстве азотной кислоты, должен быть селективным относительно реакции (1), то есть основным продуктом окисления должен быть оксид азота NO. Активность к реакции окисления аммиака проявляют подавляющее большинство металлов, их сплавов и соединений; но высокий выход оксида азота NO (более 90%) при температурах 600-1000°С обеспечивают в основном металлы платиновой группы.
В промышленной практике нашли применение сплавы платины (Pt) с родием (Rh), палладием (Pd) и рутением (Ru).
В отечественной промышленности широкое применение нашли катализаторы Сплав №1 и Сплав №5.
Таблица 2
Химический состав отечественных катализаторов окисления аммиака.
| Платины (Pt) | Палладий (Pd) | Родий (Rh) | Рутений (Ru) | |
| Сплав №1 | 92,5 | 4,0 | 3,5 | - |
| Сплав №5 | 81,0 | 15,0 | 3,5 | 0,5 |
Применяются катализаторы в виде сеток, что позволяет использовать конверторы простой конструкции. Диаметр нити сетки составляет 0,09 мм, размер стороны ячейки 0,22 мм, число ячеек 32 на 1 см длины и 1024 на 1 см2.
При оценке процесса окисления аммиака на платиновых катализаторах используются следующие понятия:
Напряженность катализатора – количество аммиака, окисленного на 1 м2 активной поверхности новой сетки или отнесенного к 1 г загружаемого катализатора; измеряется в единицах м3/(м2·сут) или м3/(г·сут).
Пробег или время работы сеток характеризует действительный срок эксплуатации катализатора с момента загрузки новых сеток до их выгрузки; измеряется в часах.
Вложения катализатора – масса металлов в граммах, отнесенная к суточной производительности аппарата или к количеству кислоты, выработанному за пробег катализатора.
Прямые потери платиноидов – потери массы сеток в граммах за пробег, отнесенные к количеству кислоты в тоннах (в пересчете на моногидрат).
Удельные потери платиноидов – потери массы сеток за пробег в граммах за вычетом количества уловленных и собранных в шламах платиноидов, отнесенные к количеству выработанной кислоты в тоннах.
Количество катализаторных сеток зависит от давления, используемого при проведении процесса окисления аммиака. В аппаратах, работающих при атмосферном давлении, количество сеток составляет от 2 до 4, в большинстве случаев используют 3 катализаторных сетки. В аппаратах, работающих при давлении 0,4-0,5 МПа, количество сеток составляет 6; при давлении 0,8 МПа – 14-16 сеток.
При оптимальных условиях проведения процесса степень превращения аммиака в оксид азота NO (данную величину еще называют степенью контактирования или степенью конверсии) на одной сетке может достигать 86-90%, на двух сетках – 95-97%, на трех сетках – 98%.
На новых сетках высокая степень конверсии достигается не сразу, а в течение некоторого срока эксплуатации. В процессе эксплуатации поверхность платиновых сеток сильно разрыхляется, гладкие блестящие нити становятся губчатыми и матовыми. В результате чего поверхность становится более развитой, что и приводит к повышению активности катализатора.
Со временем сетки катализатора изнашиваются, происходит унос металлов.
Неплатиновые катализаторы окисления аммиака.
Высокая стоимость и дефицит металлов платиновой группы обусловили поиск неплатиновых, оксидных катализаторов окисления аммиака.
При температуре 800-900°С и атмосферном давлении каталитическая активность индивидуальных оксидов металлов уменьшается в ряду:
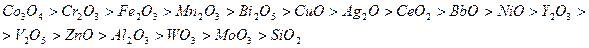
Данная последовательность, за небольшими исключениями, характерна и для селективности окисления аммиака с получением оксида азота NO. Но при этом даже самые активные оксиды металлов уступают платине по каталитическим свойствам.
В результате многочисленных исследований было предложено много вариантов смесей неплатиновых катализаторов, причем основными компонентами в них в основном выступают оксиды кобальта, железа или хрома.
Недостатками неплатиновых катализаторов является быстрая потеря активности и более высокая температура использования. Поэтому в промышленности иногда используют двухслойные катализаторы, состоящие из платиновых сеток и слоя неплатиновых катализаторов. Неплатиновые катализаторы изготавливают в виде таблеток или наносят на носитель (оксид алюминия Al2O3). На рисунке 1 представлена схема расположения двухслойного катализатора.
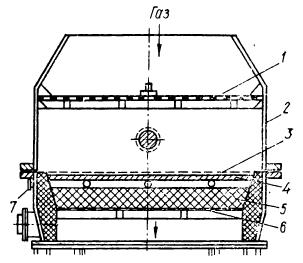
| Рис.1. Схема размещения двухслойного катализатора в аппарате: 1 – распределительная решетка; 2 – корпус аппарата; 3 – платиновая сетка; 4 – слой неплатинового катализатора; 5 – насадка; 6 – опорная решетка; 7 – карман для термопары. |
На выход того или иного продукта окисления аммиака помимо катализатора оказывают влияние параметры проведения процесса.
Влияние технологических параметров на процесс окисления аммиака.
Температура. Реакция окисления аммиака на различных катализаторах начинается при различных температурах (так на палладии окисление начинается при 100°С; на платине при 195°С; на железе при 230°С). На оксидах металлов температура начала реакции колеблется в широком диапазоне. При этом в зависимости от температуры на одном и том же катализаторе продукты окисления могут быть различными. Так при температуре около 200°С на платиновом катализаторе образуется преимущественно газообразный азот, а выход NO является небольшим. С повышением температуры содержание NO будет увеличиваться, а азота N2 – уменьшаться. К тому же с увеличением температуры увеличивается скорость протекания реакции; что в свою очередь позволяет уменьшить время контактирования реакционной газовой смеси с поверхность катализатора.
Так как при окислении аммиака возможно протекание многих реакций, каждая из которых имеет свое значение теплового эффекта, то и температура газовой смеси по мере протекания процесса изменяется.
Установлено, что при окислении 1% NH3 до NO происходит разогрев газа на 70°С. При снижении выхода NO на 1% температура увеличивается на 3°С. В реальных условиях вследствие потерь тепла разогрев газовой смеси происходит на 67-69°С на каждый процент окисленного аммиака.
Но при выборе температуры проведения процесса необходимо учитывать, что с увеличением температуры возрастают потери платиноидов.
Температурный диапазон для катализаторов на основе платины, обеспечивающий высокий выход NO и высокую скорость протекания окисления составляет 600-1000°С. С учетом тепловых эффектов протекающих реакций исходную газовую смесь необходимо подогревать. Оптимальная начальная температура газовой смеси зависит от давления.
Таблица 3
Характеристики процесса окисления аммиака
| Параметр | Давление, МПа | ||
| 0,1013 | 0,31-0,51 | 0,71-1,0 | |
| Содержание NH3 в АВС, об.% | |||
| Температура, °С - подогрева АВС - процесса | до 100 780-820 | 150-170 850-870 | 200-250 880-920 |
Давление. Применение повышенного давления в производстве азотной кислоты было вызвано главным образом необходимостью увеличением скорости окисления NO и последующего получения кислоты (то есть тех стадий, которые следуют после окисления аммиака). Помимо этого использование повышенного давления позволяет использовать более компактные установки, в том числе и на стадии окисления аммиака.
При давлении до 0,4 МПа степень окисления аммиака не сильно отличается от степени окисления аммиака при атмосферном давлении. Но при увеличении давления до 0,75 МПа при одинаковом значении температуры происходит уменьшение степени окисления аммиака примерно на 2%. Для компенсации эффекта снижения степени превращения аммиака, необходимо увеличивать температуру проведения процесса, а так же использовать большее число катализаторных сеток. Так как при проведении процесса при повышенном давлении необходимо увеличивать температуру, то в данных условиях происходит увеличение потерь катализатора, что и является главным недостатком, работающих при повышенном давлении.
Непосредственно для стадии окисления аммиака наиболее выгодно процесс проводить при атмосферном давлении, но для последующих стадий предпочтительно использовать повышенное давление. Поэтому при выборе давления проведения процесса принимают во внимание технико-экономические показатели, с учетом всех стадий производства азотной кислоты.
На рисунке 2 представлен график зависимости выхода оксида азота NO от давления при различных температурах.
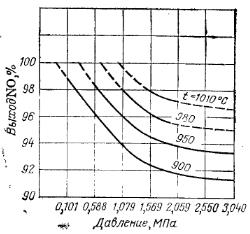
| Рис. 2. Зависимость выхода оксида азота NO от давления при различных температурах. |
Соотношение исходных компонентов в смеси. Для окисления аммиака обычно применяют воздух, поэтому содержание аммиака в смеси определяется содержанием кислорода в воздухе. Исходя из уравнения реакции (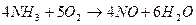 ) на 1 моль аммиака требуется 1,25 моль кислорода. При этом содержание аммиака в смеси с воздухом будет равно:
) на 1 моль аммиака требуется 1,25 моль кислорода. При этом содержание аммиака в смеси с воздухом будет равно:

Однако, при отношении O2:NH3=1,25 выход NO незначителен. Для увеличения выхода NO требуется некоторый избыток кислорода, следовательно, содержание аммиака в смеси должно быть меньше 14,4%. Зависимость степени превращения аммиака в оксид азота NO (степень конверсии, %) при различных соотношениях O2:NH3 (при температуре 900°С) представлена на рисунке 3.
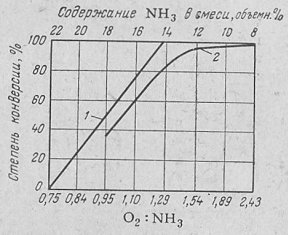
| Рис. 3. Зависимость степени конверсии аммиака в оксид азота NO от соотношения O2:NH3 в аммиачно-воздушной смеси (при температуре 900°С): 1 – теоретическая кривая; 2 – практические результаты. |
Если записать суммарную реакцию получения азотной кислоты из аммиака и кислорода:
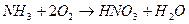 ,
,
то необходимое соотношение O2:NH3=2, либо содержание аммиака в смеси должно составлять:
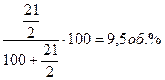 .
.
В промышленности применяют смеси, содержащие 9,5-11,5% аммиака, что соответствует отношению O2:NH3=2-1,7.
При определении содержания кислорода и аммиака в смеси необходимо учитывать взрывоопасность данных смесей. На рисунке 4 представлены данные В. Баклея и Г. Хьюза об областях воспламенения аммиачно-воздушных смесей.
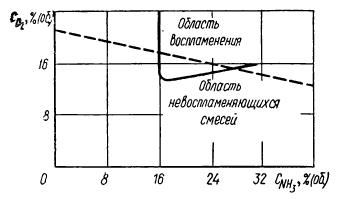
| Рис. 4. Воспламеняемость аммиачно-воздушной смеси при атмосферном давлении и 296 К. |
Область воспламенения на рисунке ограничена кривой, показывающей, что при данных условиях воспламенение начинается при концентрации аммиака 16%. Штриховая линия отражает изменение содержания кислорода в аммиачно-воздушных смесях. При концентрации аммиака 16% взрывобезопасные смеси должны содержать менее 13,5% кислорода.
Применяемые на практике аммиачно-воздушные смеси, содержащие 9,5-11,5% являются взрывобезопасные. При повышении концентрации аммиака более 12% следует учитывать пределы взрываемости газовых смесей, принимая во внимание температуру, содержание кислорода и давление.
Продолжительность контактирования. Оптимальное время контактирования при использовании платинового катализатора зависит от давления и температуры. Для новых сеток оптимальное время контактирования можно определить с использованием уравнения:
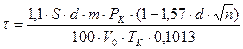
где 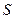 - площадь сетки, м2;
- площадь сетки, м2; 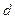 - диаметр нити проволоки, см;
- диаметр нити проволоки, см; 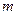 - число сеток;
- число сеток; 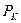 - давление, МПа;
- давление, МПа; 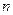 - число плетений на 1 см2 площади сеток;
- число плетений на 1 см2 площади сеток; 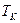 - температура конверсии, К;
- температура конверсии, К; 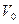 - объемная скорость газовой смеси при нормальных условиях, м3/ч.
- объемная скорость газовой смеси при нормальных условиях, м3/ч.
При проведении процесса окисления аммиака оптимальное время контактирования составляет порядка 10-4 с, выход NO составляет порядка 99%.
Для проведения процесса окисления требуется небольшое время контактирования смеси с катализатором, но если время контактирования будет меньше оптимального, то уменьшится выход NO и в смеси будет оставаться непрореагировавший аммиак. При увеличении продолжительности контактирования больше оптимального увеличивается вероятность протекания реакции с образованием азота (N2).
Время контаткирования связано со степенью превращения аммиака. При температуре 900°С на платиновом катализаторе (в пределах степени превращения аммиака от 90 до 98%) время контактирования можно определить при помощи эмпирического уравнения:
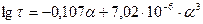 ,
,
где 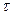 - время контактирования, с;
- время контактирования, с; 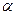 - степень конверсии,%.
- степень конверсии,%.
Помимо данного уравнения многими авторами выведены эмпирические уравнения для определения времени контактирования при различных условиях проведения процесса (температура, давление, соотношение реагентов, различные виды катализаторов и т.д.).
Наличие в исходной смеси примесей.
Все платиновые катализаторы чувствительны к веществам, которые обычно содержатся в виде примесей в аммиаке и воздухе. К веществам, снижающим активность платиновых катализаторов, относятся фосфористый и мышьяковый водород, фтор и его соединения, дихлоэтан, минеральные масла, ацетилен и другие соединения углерода, серы, фосфора, галогенов, а так же соли и оксиды металлов.
Для обеспечения необходимой продолжительности работы платиновых катализаторов установлены следующие нормы содержания примесей в сырье для производства азотной кислоты:
В воздухе, не более мг/м3:
- механические примеси – 0,007;
- сернистые соединения (в пересчете на серу) – 2,3.
В аммиаке, не более мг/м3:
- жидкое масло – 5,7 г/т;
- пары масла – 4,0;
- оксиды железа – 0,08.
Таким образом, можно сделать вывод, что степень окисления аммиака в оксид азота (II) зависит от многих факторов, таких как температура, давление, содержание аммиака в исходной смеси, наличия примесей в смеси, применяемого катализатора.
Механизм окисления аммиака.
Окисление аммиака на платиновом катализаторе относится к гетерогенным процессам. Его можно подразделить на следующие стадии:
1. Диффузия реагирующих веществ к поверхности катализатора.
2. Активированная адсорбция кислорода с образованием переходных комплексных соединений.
3. Химическое взаимодействие адсорбированных молекул с другими молекулами, находящимися в адсорбированном слое или газовом объеме.
4. Десорбция продуктов реакции с поверхности катализатора.
5. Диффузия продуктов реакции в газовый объем.
Среди ученых не существует единой точки зрения на механизм протекания окисления аммиака. Большинство ученых склоняются к механизму, который можно описать следующим образом: молекулы кислорода подходят к поверхности катализатора с ослабленной ковалентной связью. При адсорбции на поверхности катализатора эта связь разрывается и атомы кислорода образуют связь с атомами платины. В результате поверхность катализатора покрывается слоем кислорода. Молекулы аммиака адсорбируются на поверхности и разрушают непрочные связи кислорода с атомами платины, образуя в свою очередь комплексные соединения с ней. Возникают комплексы переходного состояния со связями между азотом и адсорбированным кислородом, а так же связи между водородом и кислородом. При последующем разрушении комплексов переходного состояния образуются оксид азота (NO) и вода, которые удаляются с поверхности платины.
Скорость диффузии кислорода больше, чем аммиака. Поэтому лимитирующей стадией процесса является стадия диффузии аммиака.
Различают кинетическую, переходную и диффузионную области протекания реакции окисления аммиака кислородом. Кинетическая область свойственна для низких температур. Кинетическая область ограничивается температурой зажигания катализатора, при которой отмечается быстрый самопроизвольный разогрев поверхности с переходом реакции в диффузионную область. Именно диффузионная область (600-1000°) характерна для стационарного, автотермического процесса окисления аммиака в промышленных условиях.
Особенностью кинетической области является то, что продуктом взаимодействия на большом количестве катализаторов являются N2 и N2O. В диффузионной области продуктами являются NO и N2, причем содержание NO определяется селективностью катализатора.