Модуль 2. Основные процессы химии и свойства веществ
Лабораторная работа № 7
Тема: Электролиз водных растворов солей
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении, электрического тока через раствор или расплав электролита.
При пропускании постоянного электрического тока через раствор электролита или расплав катионы движутся к катоду, а анионы - к аноду. На электродах протекают окислительнo- восстановительные процессы;. Катод, является восстановителем, так как он отдает электроны катионам, а анод - окислителем, так как ой принимает электроны у анионов. Реакции, протекающие на электродах, зависят от состава электролита, природы растворителя, материала электродов, режима работы электролизера.
Химизм процесса электролиза расплава хлорида кальция:
СаСl2 ↔ Са2+ + 2Сl-
на катоде Са2+ + 2e→ Са°
на аноде 2Сl- - 2е→ 2С1° → С12

Электролиз раствора сульфата калия на нерастворимом аноде схематически выглядит так:
K2SO4 ↔ 2K+ + SO42-
Н2О ↔ Н+ + ОН-
на катоде 2Н++ 2е→2Н°→ Н2 2
на аноде 4ОН—4е→ О2 + 4Н+ 1
K2SO4+ 4Н2О 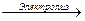 2Н2 + О2 + 2К0Н + H2SO4
2Н2 + О2 + 2К0Н + H2SO4
Цель работы: ознакомление с электролизом растворов солей.
Приборы и оборудование: выпрямитель электрического тока, электролизер, угольные электроды, наждачная бумага, стаканчики, промывалка.
Рис. 1. Прибор для проведения
электролиза
1 - электролизер;
2 - электроды;
3-токопроводящие проволоки; источник постоянного тока.
Реактивы и растворы: 5% растворы хлорида меди СuС12, иодида калия КI, гидросульфата калия KHSO4, сульфата натрия Na2SO4, сульфата меди CuSO4, сульфата цинка ZnSO4, 20% раствор  гидроксида натрия NaOH, медная и никелевая пластинки, раствор фенолфталеина, азотная кислота (конц.) HNO3, 1% раствор крахмала, нейтральная лакмусовая бумага, 10% раствор серной кислоты H2SO4.
гидроксида натрия NaOH, медная и никелевая пластинки, раствор фенолфталеина, азотная кислота (конц.) HNO3, 1% раствор крахмала, нейтральная лакмусовая бумага, 10% раствор серной кислоты H2SO4.
Опыт 1. Электролиз хлорида меди с нерастворимыми электродами
Электролизер наполните до половины объема 5% раствором хлорида меди. Опустите в оба колена электролизера по графитовому стержню, закрепите их неплотно отрезкам и каучуковой трубки. Концы электродов соедините проводниками с источниками постоянного тока. При незначительном запахе хлора электролизер немедленно отключите от источника тока. Что происходит на катоде? Составьте уравнения электродных реакций.
Опыт 2. Электролиз иодида калия с нерастворимыми электродами
Наполните электролизер 5% раствором иодида калия,. прибавьте в каждое колено по 2 капли фенолфталеина. Вставьте в каждое колено электролизера графитовые электроды и соедините их с источником постоянного тока.
В каком колене и почему окрасился раствор? В каждое колено добавьте по 1 капле крахмального клейстера. Где и почему выделяется иод? Составьте уравнения электродных реакций. Что образовалось в катодном пространстве?
Опыт 3. Электролиз сульфата натрия с нерастворимыми электродами
Половину объема электролизера наполните 5% раствором сульфата натрия и добавьте в каждое колено по 2 капли метилоранжа.или лакмуса. Вставьте в оба колена электроды и соедините их с источником постоянного тока. Запишите ваши наблюдения. Почему растворы электролита у разных электродов окрасились в разные цвета? Составьте уравнения электродных реакций. Какие газы и почему выделяются на электродах? В чем заключается сущность процесса электролиза водного раствора сульфата натрия