Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO 3 + H 2 O → H 2 SO 4
При этом оксид кремния (IV) с водой не реагирует:
SiO 2 + H 2 O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H 20 + Cl 20 → 2H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO 4 + 2H 2 O → 2Cu + 2H 2 SO 4 + O 2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO 3 + H 2 SO 4 → CaSO 4 + 2H 2 O + CO 2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO 3 → H 3 PO 4 + 5NO 2 + H 2 O
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H 2 O → H 3 O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H 2 SO 3 ↔ H + + HSO 3–
HSO 3– ↔ H + + SO 32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH) 2 + 2HBr → CuBr 2 + 2H 2 O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH) 2 + H 2 SiO 3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
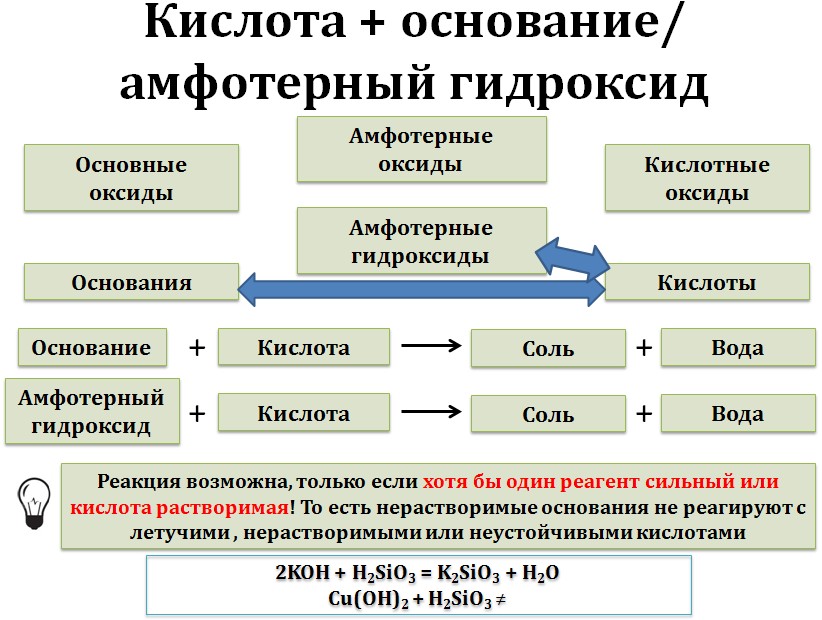
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь (избыток) + кислота = средняя соль + вода
щёлочь + многоосновная кислота (избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H 3 PO 4 → NaH 2 PO 4 + H 2 O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H 3 PO 4 → Na 2 HPO 4 + 2H 2 O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H 3 PO 4 → Na 3 PO 4 + 3H 2 O

4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH 3 COOH + Al(OH) 3 → (CH 3 COO) 3 Al + 3H 2 O

5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
2HI — + 2Cu +2 Cl 2 → 2HCl + 2Cu + Cl + I 20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота 1 + растворимая соль 1 = соль 2 + кислота 2 /оксид + вода

Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag + NO 3— + H + Cl — → Ag + Cl — ↓ + H + NO 3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2
5. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль 1 + кислота 1 = средняя соль 2 + кислота 2 /оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO 3 + HCl → KCl + CO 2 + H 2 O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H 3 PO 4 + K 2 HPO 4 → 2KH 2 PO 4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H 2 SO 4 + (CuOH) 2 CO 3 → 2CuSO 4 + 3H 2 O + CO 2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействет с соляной кислотой:
Al(OH)Cl 2 + HCl → AlCl 3 + H 2 O
6. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:

При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H 2 ↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H + Cl → Fe +2 Cl 2 + H 20
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
7. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H 2 CO 3 → H 2 O + CO 2
H 2 SO 3 → H 2 O + SO 2
2HNO 2 → NO + H 2 O + NO 2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H 2 SiO 3 → H 2 O + SiO 2
2HI → H 2 + I 2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO 3 → O 2 + 2H 2 O + 4NO 2
