Аккумулятор является вторичным источником электрического тока, так как он может отдавать ток лишь после предварительного заряда, в отличие от гальванических элементов, которые дают ток без предварительного заряда и называются поэтому первичными элементами.
Заряд аккумулятора состоит в том, что его подключают к источнику электрического тока. В результате процесса электролиза химическое состояние пластин аккумулятора меняется и между ними устанавливается определенная разность потенциалов.
Аккумуляторы бывают двух типов – кислотные (свинцовые) и щелочные.
Кислотная аккумуляторная батарея (АКБ) представляет собой эбонитовый сосуд с налитым туда водным раствором серной кислоты (H2SO4). Электродами аккумулятора служат свинцовые, специально подготовленные пластины (рис.4). Устройство обслуживаемой АКБ приведено на рис.5
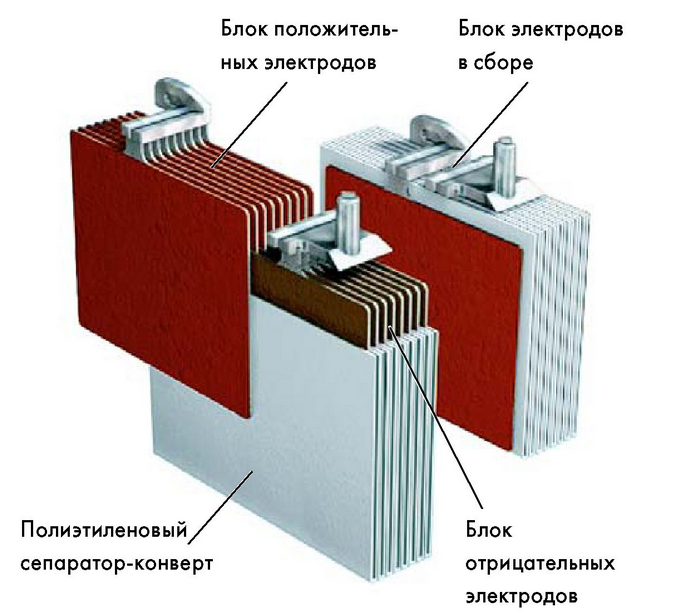
Рис.4. Электроды аккумулятора.
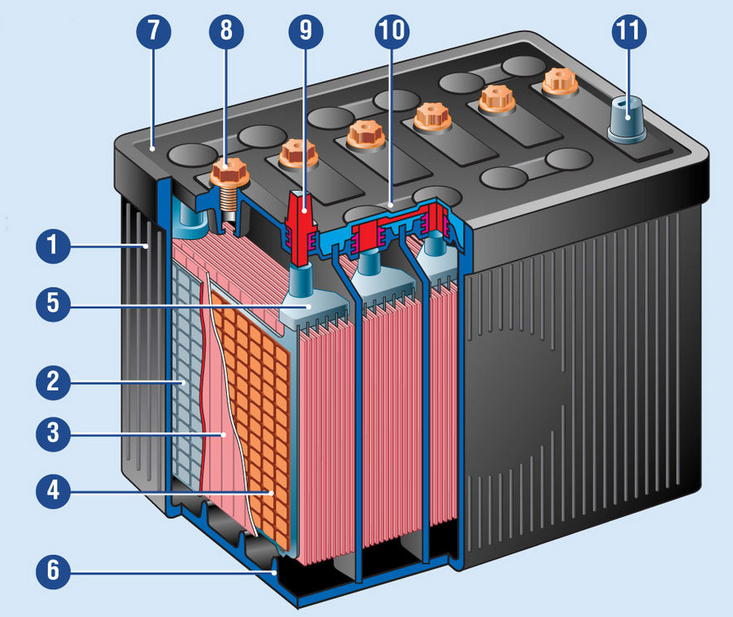
Рис.5. Устройство обслуживаемой АКБ: 1 – корпус; 2 – отрицательный электрод (пластина); 3 – сепаратор; 4 – положительный электрод (пластина); 5 – баретка; 6 – опорные призмы; 7 – крышка; 8 – пробка заливного отверстия; 9 – положительный вывод; 10 – межэлементная перемычка (соединительный мостик); 11 – отрицательный вывод.
При заряде и разряде аккумулятора в нем происходит целый ряд сложных химических реакций. Если отвлечься от побочных реакций, то в упрощенном виде процессы разряда и заряда аккумулятора можно представить примерно следующим образом.
В заряженном аккумуляторе (рис.6, а) в результате произошедших при разряде реакций положительная пластина будет состоять из перекиси свинца (PbO2), а отрицательная из губчатого свинца (Pb).
Напряжение на выводах заряженного аккумулятора равно 2-2,1 В. Если замкнуть выводы аккумулятора на сопротивление (рис.6, б), то внутри аккумулятора ток пойдет от отрицательной пластины к положительной. Так как раствор серной кислоты (H2SO4) в воде (Н2О), как говорят диссоциирован, т.е. молекулы серной кислоты распались на положительные ионы водорода (Н2) и отрицательные ионы сернокислотного остатка (SO4), то при разряде аккумулятора ионы водорода направляются к положительной пластине, а ионы сернокислотного остатка – к отрицательной. Реакции, происходящие при этом будут таковы:
на положительной пластине
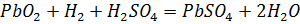 ,
,
на отрицательной пластине
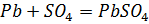 .
.
Складывая почленно обе части этих уравнений, получаем одно уравнение реакции разряда аккумулятора
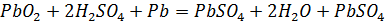 .
.
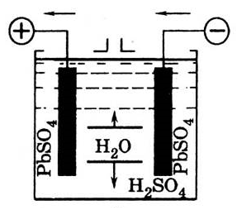
Следовательно, при разряде аккумулятора на обеих пластинах образуется сернокислый свинец 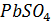 (сульфат) (рис.6, в) и выделяется вода, т.е. уменьшается плотность электролита. Полный разряд свинцового аккумулятора недопустим и его можно доводить только до 1,8 В. Во время разряда химическая энергия аккумулятора переходит в электрическую энергию.
(сульфат) (рис.6, в) и выделяется вода, т.е. уменьшается плотность электролита. Полный разряд свинцового аккумулятора недопустим и его можно доводить только до 1,8 В. Во время разряда химическая энергия аккумулятора переходит в электрическую энергию.
 а
а
|  б
б
|
 в
в
|  г
г
|
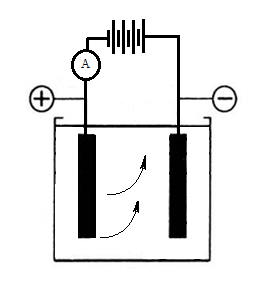
Рис.6. Кислотный аккумулятор.
а – аккумулятор заряжен; б – разряд аккумулятора; в – состояние пластин аккумулятора после разряда; г – заряд аккумулятора.
При заряде свинцового аккумулятора напряжение, которое к нему подводится, изменяется от величины около 2 В в начале заряда до 2,5-2,7 В в конце заряда. Ток от внешнего источника (6, г) будет протекать внутри аккумулятора от положительной пластины к отрицательной.
Положительные ионы водорода будут перемещаться к отрицательной пластине, а отрицательные ионы сернокислого остатка – к положительной пластине. При этом происходят следующие реакции:
на положительной пластине
 ,
,
на отрицательной пластине
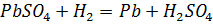 .
.
Складывая почленно обе части этих уравнений, получим
 .
.
Таким образом, после заряда на положительной пластине образуется перекись свинца 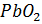 (коричневого цвета), а на отрицательной пластине – губчатый (пористый) свинец
(коричневого цвета), а на отрицательной пластине – губчатый (пористый) свинец 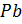 (светло-серого цвета), т.е. пластины аккумулятора возвращаются к своему первоначальному состоянию (
(светло-серого цвета), т.е. пластины аккумулятора возвращаются к своему первоначальному состоянию (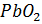 и
и 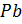 ) (рис.4, а), а плотность электролита увеличивается.
) (рис.4, а), а плотность электролита увеличивается.
Во время заряда электрическая энергия постороннего источника тока превращается в химическую энергию, т.е. аккумулируется.
Заряжать и разряжать аккумулятор только током, рекомендуемым заводом-изготовителем. Заряд и разряд током сверх нормы коробит и разрушает пластины.
Щелочные аккумуляторы. Кроме кислотных аккумуляторов, нашли широкое применение также щелочные аккумуляторы. Пластинами в них являются железные решетки с различной активной массой. Массой положительной пластины (анода) является гидрат закиси никеля, а отрицательной пластины (катода) – гидраты закиси кадмия и железа. Электролитом является раствор едкого калия. Реакции, протекающие в щелочном аккумуляторе, могут быть представлены так:
Анод:
заряд
гидрат закиси никеля -----→ гидрат окиси никеля
←-----
разряд
Катод:
заряд
гидрат закиси кадмия + гидрат закиси железа -----→ кадмий + железо
←-----
разряд
Напряжение, которое нужно подать щелочному аккумулятору для заряда 1,8 В. Рабочее напряжение аккумулятора 1,25 В, разрядное напряжение 1 В.
Сравнивая между собой кислотные и щелочные аккумуляторы, можно увидеть, что каждый из них обладает своими преимуществами и своими недостатками.
К достоинствам щелочных аккумуляторов по сравнению с кислотными относятся:
- прочность конструкции и нечувствительность к механическим сотрясениям;
- малая чувствительность к колебаниям зарядного и разрядного токов и перегрузке;
- меньшее количество вредных газов и испарений.
К недостаткам щелочных аккумуляторов относятся:
- меньшее рабочее напряжение по сравнению с кислотными аккумуляторами;
- меньший КПД;
- большее внутреннее сопротивление.
Способность аккумулятора отдавать электрическую энергию характеризуется его емкостью. Емкостью кислотного или щелочного аккумулятора называется количество электричества, отданное им во время разряда. Емкость измеряется в ампер-часах и получается путем умножения разрядного тока, указанного заводом- изготовителем, на число часов разряда.
Так, например, если на паспорте щелочного аккумулятора поставлена емкость 60 Ач и разрядный ток 7,5 А, аккумулятор можно разряжать в течение 60/7,5=8 час. И при этом напряжение его в 1,25 В уменьшится до 1В. Если этот же аккумулятор разряжать меньшим током (большим нельзя), например, в 4А, то аккумулятор можно использовать в течение 60/4=15 час.