Одним из важнейших элементов внутренней цепи является граница раздела электрод-ионный проводник. На этой границе возникает так называемый двойной электрический слой, характеризуемый сложным взаимодействием металла с компонентами раствора, которое приводит к скачку потенциала, который называют электродным потенциалом. Величина этого скачка потенциала зависит от природы электрода, состава электролита и температуры. Абсолютное значение электродного потенциала определить нельзя, но можно измерить разность потенциалов между двумя электродами. Такой электродный потенциал принято обозначать  , где нижний индекс “Ox/Red” обозначает соответственно окислительную (Ox) и восстановительную (Red) формы вещества потенциалопределяющей реакции, т. е. реакции, определяющей значения потенциала электрода:
, где нижний индекс “Ox/Red” обозначает соответственно окислительную (Ox) и восстановительную (Red) формы вещества потенциалопределяющей реакции, т. е. реакции, определяющей значения потенциала электрода:
Ox + n 
 Red, (1.1).
Red, (1.1).
Электродный потенциал в отсутствии тока в цепи при равновесии потенциалопределяющей реакции называется равновесным и обозначается  . Электродный потенциал при протекании электрического тока отличается от равновесного и обозначается
. Электродный потенциал при протекании электрического тока отличается от равновесного и обозначается  . Если и окисленная, и восстановленная формы потенциалопределяющей реакции находятся в стандартном состоянии (
. Если и окисленная, и восстановленная формы потенциалопределяющей реакции находятся в стандартном состоянии ( и
и  ), то потенциал такого электрода называется стандартным и обозначается
), то потенциал такого электрода называется стандартным и обозначается  .
.
В электрохимии общепринятой является водородная шкала потенциалов, в которой за нуль принят потенциал стандартного водородного электрода при 298 К;  . Стандартный водородный электрод относится к так называемым газовым электродам и состоит из платинированной пластины (Pt/Pt), помещенной в раствор кислоты с активностью
. Стандартный водородный электрод относится к так называемым газовым электродам и состоит из платинированной пластины (Pt/Pt), помещенной в раствор кислоты с активностью  моль/л, через который пропускают газообразный водород под давлением 105 Па (
моль/л, через который пропускают газообразный водород под давлением 105 Па ( ).
).
Потенциалопределяющей на таком электроде является реакция
2H+(p) + 2 
 H2, (1.2).
H2, (1.2).
Значения стандартных потенциалов электродов в водных растворах при 298 К, определенные по водородной шкале представлены в таблице 1 Приложения.
Значения равновесных потенциалов для условий, отличительных от стандартных, рассчитывают по уравнению Нернста, которое в общем случае для потенциалопределяющей реакции (1.1) имеет вид:
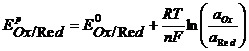 , (1.3)
, (1.3)
где – R – универсальная газовая постоянная, 8,31Дж/моль.К; n – число электронов, принимающих участие в реакции (равно числу моль эквивалентов в моль вещества); F – число Фарадея, 96500 Кл/моль-экв (26,8А.ч/моль-экв); T – температура, К.
Существует 3 различных типов электродов: 1) металлические (металлы в растворе собственных ионов); 2) газовые (на основе Pt в растворе электролита, через который пропускает соответствующий газ); 3) окислительно-восстановительные (инертный электрод в растворе, содержащей окисленную и восстановленную формы в ионном виде – редокс-электроды).
Для металлических электродов потенциалопределяющей является реакция:
M(р)n+ + n 
 M(тв).
M(тв).
Уравнение Нернста для расчета потенциала металлического электрода, поскольку активность твердой фазы принимают равной единице, имеет вид:
 , (1.4).
, (1.4).
Для 298 К, переходя к десятичному логарифму, имеем
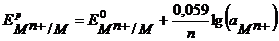 , (1.4 а);
, (1.4 а);
Для водородного электрода потенциалопределяющая реакция (1.2), уравнение Нернста запишем в виде:
 , (1.5).
, (1.5).
Поскольку, как указано выше,  , а
, а  , то при 298 К имеем выражение для расчета:
, то при 298 К имеем выражение для расчета:
 , (1.5а).
, (1.5а).
Газовый кислородный электрод представляет собой Pt – электрод, на котором осуществляется потенциалопределяющая реакция
О2 + 4  + 2Н2О
+ 2Н2О  4ОН-, (1.6).
4ОН-, (1.6).
Уравнение Нернста для такого электрода запишется в виде:
 , (1.7).
, (1.7).
Стандартный потенциал кислородного электрода  = 0,401В (при
= 0,401В (при  и
и  моль/л) по водородной шкале.
моль/л) по водородной шкале.  При 293 К, учитывая что
При 293 К, учитывая что  , имеем удобное выражение для расчета потенциала кислородного электрода:
, имеем удобное выражение для расчета потенциала кислородного электрода:
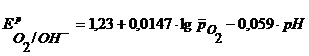 , (1.7а).
, (1.7а).
Законы Фарадея. Количественно электрохимические превращения веществ подчиняются двум законам Фарадея:
1) масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества;
2) при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны молярным массам их эквивалентов. Из этого следует, что для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея.
Оба эти закона можно объединить следующими выражениями:
- для массы вещества:  ,
,
- для объема газообразных веществ:  ,
,
где МЭ – молярнаямасса эквивалента вещества, г/моль,  ;
;
VЭ – объем моль-эквивалента газа, л/моль;  ;
;
Q – количество электричества, прошедшего через систему, Кл,
 , где I – сила тока, А; t – время процесса, с.
, где I – сила тока, А; t – время процесса, с.
(При нормальных условиях (н.у.) 1 моль любого газа занимает объем
 m = 22,4 л, поэтому объем 1 моля эквивалента водорода при н.у. составляет
m = 22,4 л, поэтому объем 1 моля эквивалента водорода при н.у. составляет  л; для кислорода
л; для кислорода  л.)
л.)
Количество моль-эквивалентов веществ, испытавших электрохимические превращения на катоде и аноде, выраженные в моль-эквивалентах, равны между собой 
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия превращается в электрическую.

Рис. 1.1. Схема гальванического элемента
Представленный на рисунке 1.1. ГЭ состоит из двух электродов 1 (катода К и анода А), погруженных в растворы собственных солей (2) и разделенных диафрагмой (3) проницаемой для ионов. Электроды через внешнюю цепь (4) соединены между собой металлическими проводниками.
При разомкнутой цепи в ГЭ на обоих электродах устанавливается равновесие, характеризуемое величиной соответствующих равновесных электродных потенциалов (ЭП). Разность равновесных ЭП катода и анода называется электродвижущей силой ГЭ:
 , (2.1).
, (2.1).
Разность стандартных ЭПназывается стандартной ЭДС ГЭ:

 , (2.1а).
, (2.1а).
При замыкании цепи равновесие нарушается, во внешней цепи возникает самопроизвольное направленное движение электронов от анода – электрода с меньшим потенциалом, к катоду – электроду с большим потенциалом.
Электродные реакции, например, для серебряно-цинкового элемента записываются следующим образом:

 (2.2).
(2.2).
Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag+ → 2Ag + Zn2+, (2.3).
Электродвижущая сила элемента связана с энергией Гиббса ТОР  уравнением:
уравнением:
 , (2.4),
, (2.4),
где п - количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
bB + dD → lL + mM, (2.5),
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса  рассчитывается по табличным значениям по уравнению:
рассчитывается по табличным значениям по уравнению:
 , (2.6).
, (2.6).
Таким образом стандартную ЭДС ГЭ можно определить двумя способами:
- первый способ по уравнению  ;
;
- второй способ по уравнению (2.1а), используя табличные значения стандартных потенциалов.
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:
 , (2.7),
, (2.7),
где аВ, аD, аL, aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР (2.5). Для твердых веществ активности принимают равными единице.
Максимальная электрическая работа ГЭ определяется соотношением  , Дж/моль. В то же время
, Дж/моль. В то же время  .
.
В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (D EК) и анода (D ЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)
 , (2.8).
, (2.8).
Поляризацией называется изменение потенциала электрода при прохождении электрического тока:  , где Ei - потенциал электрода под током; Еp – равновесный потенциал электрода.
, где Ei - потенциал электрода под током; Еp – равновесный потенциал электрода.
Зависимость потенциала электрода от тока графически изображается поляризационной кривой. В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U. Поляризационные кривые ГЭ представлены на рисунке 1.2.

Рис. 1.2. Поляризационные кривые ГЭ.
Пример 1.1. Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение. Выпишем из таблицы 1 приложения значения стандартных электродных потенциалов Zn и Ag:
 В,
В,  В.
В.
Т.к.  , электроны будут переходить от цинкового электрода к серебряному. Тогда серебряный электрод – катод, цинковый электрод – анод (уравнение 2.2). ТОР: (уравнение 2.3).
, электроны будут переходить от цинкового электрода к серебряному. Тогда серебряный электрод – катод, цинковый электрод – анод (уравнение 2.2). ТОР: (уравнение 2.3).
1 способ: рассчитаем  этого ГЭ по уравнению 2.1а:
этого ГЭ по уравнению 2.1а:
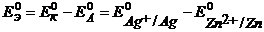 = 0,799 – (– 0,763) = 1,562 В
= 0,799 – (– 0,763) = 1,562 В
2 способ: по уравнению (2.6) рассчитываем
 (Дж);
(Дж);
По уравнению 2.4:  B.
B.
Значения  , рассчитанные первым и вторым способами, практически равны между собой.
, рассчитанные первым и вторым способами, практически равны между собой.
Пример 1.2. Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn2+ и Ag+ равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.1. Рассчитаем величины электродных потенциалов.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов (уравнение 1.4 а):
 B.
B.
 B.
B.
 B.
B.
При одинаковой активности потенциалопределяющих ионов в данном ГЭ согласно уравнению Нернста, изменение анодного потенциала больше, чем катодного, ЭДС элемента меньше, чем стандартная ЭДС.
Пример 1.3. Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.2.
Решение. Анодом ГЭ является цинковый электрод. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:


Максимально вырабатываемая электроэнергия  или Wэл = 1,23 Вт ч.
или Wэл = 1,23 Вт ч.
Пример 1.4. Рассчитайте ЭДС цинк-хлорного ГЭ, если  , и
, и 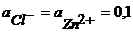 при Т = 298 К. Предложите способы увеличения
при Т = 298 К. Предложите способы увеличения 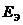 ГЭ.
ГЭ.
Решение.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn2+ + 2 
 Zn:
Zn:
 В.
В.
Для потенциалопределяющей реакции Cl2(газ) + 2 
 2Cl–(р)
2Cl–(р)
 В.
В.
Так как 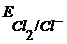 >
>  , то цинковый электрод – анод, хлорный электрод – катод, тогда уравнения электродных реакций и ТОР будут следующие:
, то цинковый электрод – анод, хлорный электрод – катод, тогда уравнения электродных реакций и ТОР будут следующие:
А-: Zn – 2  → Zn2+
→ Zn2+
К+: Cl2 + 2  → 2Cl–
→ 2Cl–
ТОР: Zn + Cl2 → Zn2+ + 2Cl–
Вычислим значения ЭДС ГЭ:  В.
В.
Увеличить ЭДС данного ГЭ можно, если: увеличить температуру; уменьшить активность ионов Zn2+; уменьшить активность ионов Cl– ; увеличить парциальное давление Cl2.
Пример 1.5. Рассчитайте ЭДС щелочного водородно-кислородного ГЭ, работающего при одинаковых давлениях  ,
,  .
.
Решение. Для кислой среды уравнения электродных реакций в концентрационном элементе:
А -: H2 +2ОН-→ 2Н2О + 2 
К+: 1/2О2 + 2  + Н2О
+ Н2О  2ОН-,
2ОН-,
H2 + 1/2О2 → Н2О
Величина равновесного потенциала этих электродов определяется по уравнению:
 =
=
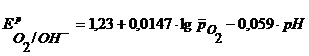 =
=
 =1.23B
=1.23B
Для кислотного водородно-кислородного топливного элемента:
на аноде: H2 - 2  → 2H+
→ 2H+
на катоде: 1/2О2 + 2H+ + 2 
 Н2О
Н2О
 =1.23 В
=1.23 В
Поляризационные кривые:
3. ЭЛЕКТРОЛИЗ
Электролизом называются электрохимические процессы прямого (непосредственного) преобразования электрической энергии в химическую, протекающие на электродах под действием постоянного тока. Под действием электрического поля беспорядочное движение ионов в электролите превращается в направленное: положительно заряженные ионы (катионы) перемещаются к отрицательному электроду – катоду, отрицательно заряженные ионы (анионы) движутся к положительному электроду – аноду.
При электролизе катод подсоединяется к отрицательному полюсу внешнего источника тока, а анод – к положительному. На катоде (К–) происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают электроны и переходят в восстановленную форму. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители. На аноде (А+) могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятся Zn, Cu, Fe, Cd, Ag, Ni, Co и т.д., к нерастворимым – Pt, Pd и некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Для того, чтобы правильно определить процессы электролиза, необходимо рассмотреть ионный состав электролита и определить равновесные потенциалы возможных процессов. Для расчета равновесных потенциалов возможных процессов, используется уравнение Нернста. Если не указаны конкретные условия, то для оценочной характеристики процессов используются стандартные потенциалы материала анода  , анионов
, анионов  и катионов
и катионов  . Равновесные потенциалы процессов выделения кислорода и водорода при относительных парциальных давлениях газов
. Равновесные потенциалы процессов выделения кислорода и водорода при относительных парциальных давлениях газов  и Т = 298 К рассчитываются по формулам:
и Т = 298 К рассчитываются по формулам:
 , (3.1),
, (3.1),
 , (3.2).
, (3.2).
При относительно малом отличии равновесных потенциалов (менее 0,8 ¸ 1,0 В) на электродах возможно параллельное протекание нескольких процессов. Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj):
 , (3.3),
, (3.3),
где Qj – количество электричества, пошедшее на конкретный процесс;
Q – общее количество электричества, прошедшее через электрохимическую систему.
Сложные кислородсодержащие ионы, такие как SO42-, NO3-, PO43- и др. из водных растворов на аноде не окисляются, т.к. обладают существенно более положительным потенциалом разряда, чем гидроксид-ион OH–.
Ионы элементов (приложение 1, табл. 1), обладающие высоко отрицательным электродным потенциалом (Al3+, Na+ и др.) из водных растворов на катоде не восстанавливаются. Их разряд на катоде возможен только из расплавов соответствующих солей или из неводных растворов.
Количество вещества, испытавшего электрохимические превращения на электродах, рассчитывается по закону Фарадея.
При электролизе в результате прохождения через систему постоянного электрического тока происходит поляризация электродов (D Е К, D Е А): потенциал анода становится более положительным, а потенциал катода – более отрицательным и возникает омическое падение напряжения на внутреннем сопротивлении электрохимической цепи R (D Е ом = R.I). Поэтому напряжение (U), которое необходимо подать на электроды от внешнего источника постоянного тока, больше минимальной разности потенциалов (Umin), равной разности равновесных потенциалов процессов:
 , (3.4).
, (3.4).
Ход поляризационных кривых при электролизе показан на рис. 3.1.:
|
|

|
Рис. 3.1. Поляризационные кривые при электролизе.
Пример 3.1. Рассмотрите электролиз расплава соли хлорида лития LiCl на нерастворимых Pt-электродах. Рассчитайте минимальную разность потенциалов Umin электролиза. Напишите уравнения электродных процессов.
Решение. Запишем ионный состав электролита:
LiCl → Li+ + Cl-
и стандартные потенциалы электродных процессов:
К-: 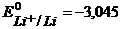 B,
B,
A+ :  В.
В.
 B.
B.
Электродные процессы:
K-: Li+ +  → Li
→ Li
A+: 2Cl- → Cl2 + 2  .
.
Данный электролиз можно использовать для получения лития и хлора.
Пример 3.2. Определите минимальную разность потенциалов Umin, которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение. Запишем уравнения диссоциации раствора электролита
КОН → К+ + ОН- ; H2O  H+ + OH-
H+ + OH-
и определим равновесные потенциалы возможных электродных процессов:
К-:  B,
B,  В,
В,
А+:  В.
В.
Так как Е0 К+/К значительно отрицательнее  , то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН-:
, то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН-:
К-: 2Н2О + 2е → Н2 + 2ОН-,
А+: 4ОН- - 4е → О2 + 2Н2О.
Минимальная разность потенциалов для электролиза данного раствора:
 B.
B.
Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):
 л,
л,
 л.
л.
Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Пример 3.3. Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2.
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
CuCl2 → Cu2+ + 2Cl-
H2O  H+ + OH-.
H+ + OH-.
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Определим потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
К-: 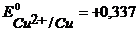 B,
B,  B,
B,
т.к.  более положителен, чем
более положителен, чем  , то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
, то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
A+ :  В,
В,  В,
В,
т.к.  более отрицателен, чем
более отрицателен, чем  , то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
, то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
K-: Cu2+ + 2  → Cu
→ Cu
A+: 2H2O → O2 + 4H+ + 4 
2Cl- → Cl2 + 2  .
.
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
 |
Рис. 3.2. Поляризационные кривые процесса электролиза водного раствора хлорида меди на нерастворимых электродах.
Определим массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:
 л/моль,
л/моль,  л/моль,
л/моль,  г/моль.
г/моль.
По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):
 Кл,
Кл,
 Кл.
Кл.
Суммарное количество электричества, прошедшее через анод, равно:
 Кл.
Кл.
Такое же количество электричества на катоде (Q К = Q А) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:
 г = 48,3 мг
г = 48,3 мг
Определим выход по току (Bj) для всех процессов электролиза:
 %, (т.к. на катоде идет один процесс);
%, (т.к. на катоде идет один процесс);
 %;
%;  %.
%.
Пример 3.4. Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного в примере 3.3.?
Решение. Ионный состав раствора электролита таков же, как в примере 3.3., поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:
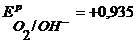 В,
В,  В, (см. пр. 3.3), потенциал материала анода
В, (см. пр. 3.3), потенциал материала анода 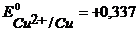 В. Так как равновесный потенциал окисления меди значительно отрицательнее равновесных потенциалов выделения кислорода и хлора, то на аноде в первую очередь пойдет процесс окисления медного электрода. Если при электролизе на катоде и аноде не будут достигнуты равновесные потенциалы систем
В. Так как равновесный потенциал окисления меди значительно отрицательнее равновесных потенциалов выделения кислорода и хлора, то на аноде в первую очередь пойдет процесс окисления медного электрода. Если при электролизе на катоде и аноде не будут достигнуты равновесные потенциалы систем  и
и  (небольшие поляризации D Е К, D Е А и плотности тока i), то электродные процессы будут следующие:
(небольшие поляризации D Е К, D Е А и плотности тока i), то электродные процессы будут следующие:
K-: Cu2+ + 2  → Cu
→ Cu
A+: Cu → Cu2+ + 2  .
.
При больших напряжениях электролизера U, могут быть достигнуты  ,
, 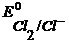 и
и  , тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из примера 3.3.
, тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из примера 3.3.
Благодаря растворению под действием тока медного анода запас ионов Cu2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (пр. 3.3.).



Рис. 3.3. Поляризационные кривые процесса электролиза водного раствора хлорида меди на медных электродах.
Пример 3.5. Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
Pb(NO3)2 → Pb2+ + 2NO3-
Sn(NO3)2 → Sn2+ + 2NO3-
H2O  H+ + OH-.
H+ + OH-.
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Определим равновесные потенциалы возможных процессов на аноде и катоде:
К-:  B,
B,  B,
B,
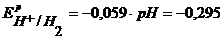 В.
В.
т.к.  ,
,  и
и  имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита. На аноде ионы NO3-, как сложные кислородсодержащие ионы, окисляться не будут, и в данном растворе электролита на нерастворимом аноде будет идти только процесс окисления ионов ОН-.
имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита. На аноде ионы NO3-, как сложные кислородсодержащие ионы, окисляться не будут, и в данном растворе электролита на нерастворимом аноде будет идти только процесс окисления ионов ОН-.
Таким образом, на электродах протекают следующие процессы:
K-: Pb2+ + 2e → Pb
Sn2+ + 2e → Sn
2H+ + 2e → H2
A+: H2O → O2 + 4H+ + 4  .
.
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:
 г/моль,
г/моль,  г/моль,
г/моль,  л/моль (н.у.).
л/моль (н.у.).
По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):
 Кл,
Кл,
 Кл,
Кл,
 Кл.
Кл.
Суммарное количество электричества, прошедшее через катод:
 Кл.
Кл.
Определим выход по току (Bj) для всех процессов электролиза:
 o/o, (т.к. на аноде идет один процесс);
o/o, (т.к. на аноде идет один процесс);
 100 % =
100 % =  100% = 40,2%;
100% = 40,2%;
 100% = 39,9%;
100% = 39,9%;  100% = 19,9%.
100% = 19,9%.

Рис. 3.4. Поляризационные кривые процесса электролиза водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах.
Пример 3.6. Рассмотрите процесс рафинирования никеля, содержащего примеси цинка и меди в водном растворе H2SO4. Какие процессы будут протекать на аноде и катоде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение. Рафинирование – очистка металла от примесей с помощью электролиза. На аноде растворяются основной металл и примеси, потенциал которых отрицательнее основного металла. Примеси, имеющие более положительный потенциал, не растворяются и выпадают из анода в виде шлама. На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал.
Анод – очищаемый металл Ni с примесями Zn и Cu. Ионный состав раствора электролита: H+, SO42-, OH-. Запишем равновесные потенциалы возможных электродных процессов при рН = 2:
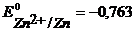 B,
B, 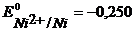 B,
B, 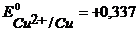 B,
B,
 В,
В,  B.
B.
Так как  <
<  <
<  <
<  , то первым на аноде при рафинировании пойдет процесс окисление примесей цинка, затем - окисление основного металла (никеля), примеси меди не растворяются, а выпадают в осадок (шлам) в виде частиц металла по окончании процесса.
, то первым на аноде при рафинировании пойдет процесс окисление примесей цинка, затем - окисление основного металла (никеля), примеси меди не растворяются, а выпадают в осадок (шлам) в виде частиц металла по окончании процесса.
Так как  >
>  , и концентрация ионов никеля выше, чем концентрация ионов цинка, то на катоде осаждается чистый никель. Однако, в начале процесса, когда в растворе электролита отсутствуют ионы Ni2+, на катоде идет процесс выделения водорода.
, и концентрация ионов никеля выше, чем концентрация ионов цинка, то на катоде осаждается чистый никель. Однако, в начале процесса, когда в растворе электролита отсутствуют ионы Ni2+, на катоде идет процесс выделения водорода.
Запишем уравнения электродных процессов:
А+: Zn → Zn2+ + 2e
Ni → Ni2+ + 2e
K-: 2H+ + 2e → H2
Ni2+ + 2e → Ni.
Время, необходимое для рафинирования, рассчитаем по закону Фарадея ( г/моль):
г/моль):
 c или τ = 9,27 ч.
c или τ = 9,27 ч.
4. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называют самопроизвольное разрушение металлических материалов под действием компонентов окружающей среды. В результате коррозии протекает суммарная окислительно-восстановительная реакция взаимодействия металла с окислителем:
nM + mOx → MnRedm, (4.1).
При этом происходит окисление металла и разрушение металлоконструкций.
Для металла именно окисленное состояние явля