Кислотно-основная классификация катионов по группам
3.1 Аналитические реакции катионов серебра Ag+
Катионы серебра (Ag+) образуют осадки со многими реагентами. Для открытия катионов серебра (I) чаще всего используют реакции образования осадков с анионами: Cl−, Br−, I−, CrO42−.
1. Катионы Ag+ при взаимодействии с растворимыми хлоридами, бромидами и иодидами образуют соответствующие осадки:
Ag+ + Cl− → AgCl↓ (3.1); Ag+ + Br− → AgBr↓ (3.2);
белый осадок желтоватый осадок
Ag+ + I− → AgI↓ (3.3).
желтый осадок
Осадок хлорида серебра растворяется в концентрированном растворе аммиака с образованием комплексного соединения:
AgCl↓ + 2 NH3 → [Ag(NH3)2]Cl. (3.4)
При подкислении раствора данного комплекса вновь выпадает осадок хлорида серебра:
[Ag(NH3)2]Cl + 2 Н+ → AgCl↓ + 2 NH4+ (3.5)
При добавлении к раствору комплекса [Ag(NH3)2]Cl раствора иодида калия KI образуется осадок иодида серебра AgI↓ желтоватого цвета:
[Ag(NH3)2]Cl + KI → AgI↓ + KCl + 2 NH3 (3.6)
Осадок хлорида серебра растворяется также в концентрированном растворе соляной кислоты и растворах хлоридов, в растворе цианида калия KCN и растворе тиосульфата натрия Na2S2O3 с образованием растворимых комплексов:
AgCl↓ + Cl− → [AgCl2]− ; (3.7)
AgCl↓ + 2 KCN → K[Ag(CN)2] + KCl; (3.8)
AgCl↓ + 2 Na2S2O3 → Na3[Ag(S2O3)2] + NaCl. (3.9)
Открытию катионов серебра (I) реакцией с ионами хлорида мешают катионы Pb2+, Hg22+, образующие малорастворимые осадки хлоридов.
2. При взаимодействии с концентрированным раствором H2SO4 или растворами сульфатов катион Ag+ осаждается в виде белого осадка сульфата:
2 Ag+ + SO42− → Ag2SO4↓. (3.10)
белый осадок
3. При взаимодействии с карбонатами щелочных металлов катион Ag+ осаждается в виде желтого осадка карбоната:
2 Ag+ + CO32− → Ag2CO3↓. (3.11)
желтый осадок
4. При взаимодействии катионов серебра Ag+ с анионами хромата CrO42− в нейтральной среде (рН ≈ 6,5-7,5) выпадает осадок хромата серебра кирпично-красного цвета:
2 Ag+ + CrO42− → Ag2CrO4↓. (3.12)
кирпично-красный ос.
Осадок растворим в кислотах; в концентрированном растворе аммиака с образованием комплексного соединения:
AgCrO4↓ + 4 NH3 → [Ag(NH3)2]2CrO4. (3.13)
Если реакцию между катионом Ag+ и анионом хромата CrO42− проводить в щелочной среде, то в осадок выпадает оксид серебра Ag2O. В уксуснокислой среде образуется бихромат серебра Ag2Cr2O7↓, осадок красно-бурого цвета.
Данной реакции мешают все катионы, образующие малорастворимые хроматы (Sr2+, Ba2+, Hg22+, Hg2+, Pb2+).
5. Среди других реакций катионов серебра Ag+ наиболее употребительны следующие. При взаимодействии катионов серебра Ag+ с сероводородом H2S или растворами сульфидов образуется черно-коричневый осадок сульфида серебра Ag2S. Со щелочами образуется черный осадок оксида серебра Ag2O. С тиоцианатом калия KNCS образуется белый осадок тиоцианата серебра AgNCS, растворимый в избытке реагента. С тиосульфатом натрия Na2S2O3 образуется белый осадок тиосульфата серебра Ag2S2O3, растворимый в избытке реагента. С гидрофосфатом натрия Na2HPO4 образуется желтый осадок ортофосфата серебра Ag3PO4. С гексацианоферратом (II) калия K4[Fe(CN)6] и гексацианоферратом (III) калия K3[Fe(CN)6] образуются белый осадок Ag4[Fe(CN)6] и кирпично-красный осадок Ag3[Fe(CN)6] соответственно.
3.2 Аналитические реакции катионов ртути (I) Hg22+
1. Катионы Hg22+ при взаимодействии с анионами хлорида в растворах образуют белый осадок каломели Hg2Cl2:
Hg22+ + 2 Cl− → Hg2Cl2↓. (3.14)
белый осадок
На свету осадок каломели постепенно чернеет вследствие образования тонкодисперсной металлической ртути:
Hg2Cl2↓ → HgCl2 + Hg↓. (3.15)
Осадок каломели Hg2Cl2 не растворяется в разбавленной HNO3, но растворяется в концентрированной HNO3:
3 Hg2Cl2↓ + 8 HNO3 → 3 HgCl2 + 3 Hg(NO3)2 + 2 NO↑ + 4 H2O. (3.16)
При добавлении к осадку каломели раствора аммиака он темнеет вследствие выделения тонкодисперсной металлической ртути:
Hg2Cl2↓ + 2 NH3 → NH2HgCl + Hg↓ + NH4Cl. (3.17)
Иногда протекание данной реакции (при взаимодействии с водным раствором аммиака) описывают следующим уравнением:
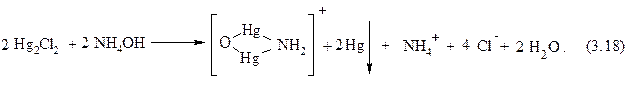
2. При взаимодействии катиона Hg22+ с серной кислотой выпадает белый осадок сульфата ртути (I):
Hg22+ + SO42− → Hg2SO4↓. (3.19)
белый осадок
Осадок выпадает из концентрированных растворов реагентов.
3. Восстановление катиона Hg22+ металлической медью до металлической ртути:
Hg22+ + Cu → 2 Hg↓ + Cu2+. (3.20)
Этой реакции мешают катионы Hg2+, дающие подобный результат.
На очищенную раствором HNO3 или водным раствором NH4OH медную пластину наносят каплю раствора соли ртути, например, Hg2(NO3)2. Через некоторое время на поверхности образуется серое пятно амальгамы меди и ртути. Это пятно после протирания поверхности фильтровальной бумагой становится блестящим, как зеркало. Это доказывает наличие в растворе катиона ртути (I).
4. Реакция с водным раствором аммиака. Катионы Hg22+ взаимодействуют с аммиаком в водном растворе с образованием черного осадка, представляющего смесь тонкодисперсной металлической ртути и соли, содержащей катион [OHg2NH2]+:
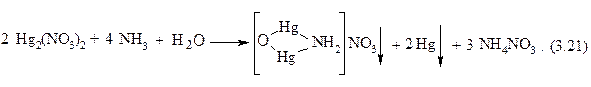
5. Катионы Hg22+ при взаимодействии с ионами иодида образуют зеленый осадок иодида ртути (I) Hg2I2, растворимый в избытке реактива с образованием прозрачного бесцветного комплексного соединения [Hg2I4]2– и металлической ртути:
Hg22+ + 2 I− → Hg2I2↓; (3.22)
Hg2I2↓ + 2 I− → [Hg2I4]2− + Hg↓. (3.23)
черный осадок
6. Карбонаты натрия и калия осаждают катионы ртути (I) в виде карбоната ртути (I) желтого цвета:
Hg22+ + СО32− → Hg2СО3↓; (3.24)
желтый осадок
Осадок карбоната ртути нестойкий и постепенно темнеет вследствие протекания реакции:
Hg2СО3↓ → HgO↓ + Hg↓ + CO2↑. (3.25)
черный осадок
7. Катионы Hg22+ образуют с анионом хромата CrO42− осадок кирпично-красного цвета Hg2CrO4:
Hg22+ + CrO42− → Hg2CrO4↓. (3.26)
кирпично-красн. ос.
Данной реакции мешают все катионы, образующие малорастворимые хроматы (Sr2+, Ba2+, Pb2+). Осадок растворяется в азотной кислоте.
8. Щелочи (NaOH, KOH) осаждают катионы ртути Hg22+ из растворов в виде черного осадка оксида ртути (I):
Hg22+ + 2 ОН− → Hg2(OH)2↓ → Hg2O↓ + H2O. (3.27)
черный осадок
9. Другие реакции катионов ртути (I). Катионы Hg22+ при взаимодействии с анионами сульфида S− образуют черный осадок, представляющий смесь соединений HgS + Hg; с анионами оксалата С2О42− они образуют белый осадок Hg2C2O4; с анионами фосфата – белый осадок (Hg2)3(PO4)2. При взаимодействии с растворами солей K4[Fe(CN)6] и K3[Fe(CN)6] катионы ртути (I) образуют соответственно светло-желтый осадок Hg4[Fe(CN)6] и желто-зеленый осадок (Hg2)3[Fe(CN)6]2.
3.3 Аналитические реакции катионов свинца (II) Pb2+
1. Катионы свинца образуют с анионами хлорида Cl− (при рН < 7) белый осадок хлорида свинца PbCl2:
Pb2+ + 2 Cl− → PbCl2↓. (3.28)
белый осадок
Хлорид свинца хорошо растворяется в воде, особенно при нагревании, поэтому катион свинца Pb2+ осаждаются из растворов в виде хлорида неполностью. Осадок PbCl2 растворяется в горячей воде, а при охлаждении раствора он вновь выпадает в виде осадка, но уже в форме игл.
Из разбавленных щелочных растворов выпадает осадок гидроксида свинца; из концентрированных щелочных растворов осадки PbCl2 и Pb(OH)2 не выпадают.
К осадку прибавляют 1,5-2,0 мл дистиллированной воды и нагревают до его растворения. При охлаждении раствора из него снова выпадает осадок хлорида свинца в виде игл.
2. Катионы свинца при взаимодействии с растворами иодидов образуют желтый осадок иодида свинца, растворимый в избытке реактива с образованием анионов тетрайодидоплюбата (II) [PbI4]2−:
Pb2+ + 2 I− → PbI2↓ (3.29); PbI2↓ + 2 I− → [PbI4]2−. (3.30)
желтый осадок
Осадок PbI2 растворяется в воде при нагревании и в растворе уксусной кислоты. При охлаждении водного раствора PbI2 из него выпадают кристаллы иодида свинца золотисто-желтого цвета.
Реакции катионов Pb2+ с ионами иодида мешают катионы: Cu2+, Ag+, Hg22+, Hg2+, Fe3+.
К смеси осадка и раствора прибавляют несколько капель воды, подкисленной уксусной кислотой, и нагревают до полного растворения осадка. При медленном охлаждении пробирки (ее погружают в холодную воду или оставляют остывать на воздухе) выпадают красивые блестящие золотисто-желтые чешуйчатые кристаллы иодида свинца. Испытывают растворимость осадка PbI2 в горячей воде и уксусной кислоте.
3. Катионы свинца Pb2+ при взаимодействии с анионами сульфата SO42− образуют белый осадок сульфата свинца:
Pb2+ + SO42− → PbSO4↓. (3.31)
белый осадок
Осадок растворяется при нагревании в щелочах (в отличие от осадков CaSO4, SrSO4, BaSO4):
t°
PbSO4↓ + 4 NaOH —→ Na2[Pb(OH)4] + Na2SO4. (3.32)
Осадок сульфата свинца растворяется также в концентрированной серной кислоте с образованием гидросульфата:
PbSO4↓ + H2SO4 → Pb(HSO4)2. (3.33)
Осадок PbSO4 растворяется в 30 %-ном растворе ацетата натрия (или аммония):
2 PbSO4↓ + 2 CH3COONa → [Pb(CH3COO)]2SO4 + Na2SO4. (3.34)
Открытию катионов свинца в виде сульфата мешают катионы: Ca2+, Sr2+, Ba2+, Hg22+.
4. Щелочи и раствор аммиака при взаимодействии с катионом Pb2+ образуют белый осадок гидроксида свинца:
Pb2+ + 2 ОН− → Pb(OH)2↓. (3.35)
белый осадок
Осадок растворим в кислотах и щелочах:
Pb(OH)2↓ + 2 H+ → Pb2+ + 2 H2O; (3.36)
Pb(OH)2↓ + 2 OH− → [Pb(OH)4]2−. (3.37)
В избытке раствора аммиака осадок Pb(OH)2 не растворяется.
5. Растворы карбонатов щелочных металлов осаждают катион Pb2+ в виде осадка карбоната свинца белого цвета:
Pb2+ + CO32− → PbCO3↓; (3.38)
белый осадок
или в виде оксокарбоната:
2 Pb2+ + CO32− + 2 H2O → Pb2(OH)2CO3↓ + 2 H+. (3.39)
белый осадок
6. Катионы свинца образуют с анионами хромата CrO42− (или бихромата Cr2O72− в уксуснокислой среде) желтый кристаллический осадок хромата свинца PbCrO4:
Pb2+ + CrO42− → PbCrO4↓; (3.40)
желтый осадок
2 Pb2+ + Cr2O72− + 2 CH3COO− + H2O → 2 PbCrO4↓ + 2 CH3COOH. (3.41)
желтый осадок
Осадок хромата свинца не растворяется в уксусной и разбавленной азотной кислотах, в водном растворе аммиака, но растворяется в щелочах с образованием бесцветного комплекса [Pb(OH)4]2−:
PbCrO4↓ + 4 NaOH → Na2[Pb(OH)4] + Na2CrO4. (3.42)
Реакции катиона свинца с хроматом мешают катионы (Ba2+, Hg2+ и др.), образующие нерастворимые хроматы.
Содержимое пробирки делят на несколько частей и испытывают растворимость осадка в азотной кислоте, растворе аммиака и растворе щелочи. Только в растворе щелочи осадок растворяется.
7. Другие реакции катионов свинца. Катионы Pb2+ образуют белый осадок PbMoO4 при взаимодействии с раствором молибдата аммония (NH4)2MoO4; белый осадок ферроцианида свинца Pb2[Fe(CN)6] при взаимодействии с гексацианоферратом (II) калия K4[Fe(CN)6]; белый осадок фосфата свинца Pb3(PO4)2 при взаимодействии с гидрофосфатом натрия Na2HPO4; черный осадок сульфида свинца PbS (растворимый в азотной кислоте) при взаимодействии с раствором сероводорода H2S или растворами растворимых сульфидов (Na2S, K2S).
В табл. 3.1 представлены продукты некоторых аналитических реакций катионов I аналитической группы по кислотно-основной классификации и свойства данных продуктов.
Таблица 3.1
Продукты некоторых аналитических реакций катионов I группы
| Реагенты | Продукты аналитических реакций катионов | ||
| Ag+ | Hg22+ | Pb2+ | |
| HCl, хлориды | Белый осадок AgCl. Растворяется в растворах NH3, KCN, Na2S2O3. | Белый осадок Hg2Cl2. | Белый осадок PbCl2. Растворяется в горячей воде. |
| H2SO4, сульфаты | Белый осадок Ag2SO4 (из концентрирован-ных растворов). | Белый осадок Hg2SO4 (из концентрирован-ных растворов). | Белый осадок PbSO4. Растворим в растворах щелочей, ацетата натрия, концентрирован-ных HCl и H2SO4. |
| H2S или Na2S, Na2S2O3 | Черный осадок Ag2S. Растворим в HNO3. | Черный осадок Hg2S. Разлагается на HgS¯ + Hg¯. | Черный осадок РbS. Растворим в HNO3. |
| NaOH, KOH | Бурый осадок Ag2O. Растворим в аммиаке. | Черный осадок Hg2O. | Белый осадок Pb(OH)2. Растворим в щелочах. |
| NH4OH | Бурый осадок Ag2O. Растворим в аммиаке. | Черный осадок Hg ¯ + HgNH2Cl¯. | Белый осадок Pb(OH)2. Растворим в щелочах. |
| Na2CO3, K2CO3 | Желтый осадок Ag2CO3. Растворим в аммиаке. | Желтый осадок Hg2CO3. Разлагается на HgO¯ + Hg¯ + CO2. | Белый осадок Pb2(OH)2CO3. Растворим в щелочах. |
| Na2HPO4 | Желтый осадок Аg3PO4. Растворим в аммиаке. | Белый осадок Hg2HPO4. Растворим в HNO3. | Белый осадок Рb3(PO4)2. Растворим в HNO3 и щелочах. |
| KI | Желтый осадок AgI. Растворим в Na2S2O3 и KCN. | Желто-зеленый осадок Hg2PO4. Растворим в HNO3. | Желтый осадок PbI2. Растворим в горячей воде, избытке KI, CH3COOH. |
| K2Cr2O7+ CH3COOH (K2CrO4) | Кирпично-красный осадок Ag2CrO4 или Ag2Cr2O7. Растворим в аммиаке. | Красный осадок Hg2CrO4. Растворим в HNO3. | Желтый осадок PbCrO4. Растворим в щелочах. |