Железо: строение атома.
Физические и химические свойства железа.
Изучение нового материала
Учитель химии и биологии
Чернышова А.А.
Изучение нового материала
Изучение строения атома
 Чтобы определить какими свойствами обладает железо, что сделало его таким незаменимым в жизни человека, надо знать строение, а для этого необходимо определить положение химического элемента в Периодической системе химических элементов Д.И. Менделеева.
Чтобы определить какими свойствами обладает железо, что сделало его таким незаменимым в жизни человека, надо знать строение, а для этого необходимо определить положение химического элемента в Периодической системе химических элементов Д.И. Менделеева.
Fe – 4 период, VIIIB группа, №26, Аr (Fe) =56
(26р+, 30n0) 26е-
 Распределение электронов по уровням и подуровням
Распределение электронов по уровням и подуровням
Fe –d-элемент.
Какие степени окисления присущи железу?
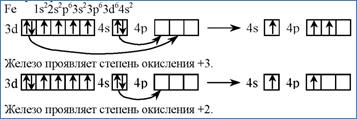
Какими свойствами обладают соединения железа?
Fe – восстановитель, металл средней активности (на основании его положения в электрохимическом ряду напряжений металлов)
Fe О, Fe (ОН) 2– основный характер,
Fe 2 О 3, Fe (ОН) 3–амфотерный характер
В чем отличие железа, металла побочной подгруппы, от изученных металлов главных подгрупп?
(Валентные электроны на s-орбитали у щелочных и щелочно-земельных металлов, р-орбитали у алюминия, а железо – d-элемент, переменная степень окисления, у металлов главных подгрупп она постоянная)
В чём сходство с металлами главных подгрупп?
(Число электронов на последнем энергетическом уровне мало, проявляет металлические свойства, а значит тип кристаллической решётки и вид химической связи – металлический)
1.2 Изучение физических свойств
Исходя из того, что мы определили сходство и отличие строения атома и простого вещества железа и металлов главных подгрупп, нам будет несложно справиться с изучением физических и химических свойств железа. Начнём с физических свойств этого металла.
Выступление учащихся с сообщением.
Физические свойства простого вещества железа
Железо – типичный металл, в свободном состоянии – серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности – углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами.
Чистое железо может иметь два состояния своей кристаллической решётки, ещё именуемых фазами.
Первая фаза называется α-железо (альфа-железо, феррит), которое устойчиво при температурах ниже 910°С и выше 1390°С и γ-железо (гамма-железо, аустенит), устойчивое в интервале температур 910°—1390°С. Кристаллическая решетка α-железа — объемно-центрированный куб, а γ-железа — гранецентрированный куб.
Различные фазы железа были впервые описаны выдающимся русским металлургом и материаловедом Дмитрием Константиновичем Черновым. Причём открытие двух фаз железа, которое позволило наконец-то понять с научной точки зрения, что происходит с железом и почему качества стали и чугуна столь разительно отличаются от качеств чистого железа, произошло достаточно поздно — уже в 1868 году, даже после появления главных изобретений Мартена и Бессемера, которые и заложили основы многих современных металлургических процессов.
Железо относится к умеренно тугоплавким металлам. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления химически чистого железа равна 1539о С. Технически чистое железо, полученное путем окислительного рафинирования, плавится при температуре около 1530о С.
Теплота плавления железа составляет 15,2 кДж/моль или 271,7 кДж/кг. Кипение железа происходит при температуре 2735оС, хотя авторами некоторых исследований установлены значительно более высокие значения температуры кипения железа (3227 - 3230о С). Теплота испарения железа составляет 352,5 кДж/моль или 6300 кДж/кг, плотность 7,87 г/см.
1.3 Изучение химических свойств железа
Используем схему, которую применяли для изучения химических свойств других металлов, не забывая о том, что железо проявляет две степени окисления.
Заполнение таблицы, по одному ученику у доски, записывают уравнение реакции, расставляют коэффициенты, указывают окислитель и восстановитель.
| Fe+2 | Fe+3 |
| Взаимодействие с простыми веществами-неметаллами | |
| 1) с серой Fe0 + S0= Fe+2 S-2 | 2)с галогенами, кроме йода 2Fe0 +3Cl2 0 = 2Fe+3Cl3-1 Почему в реакции с серой железо проявляет степень окисления +2, а с хлором – +3 (сила окислителя) |
| 3)с кислородом 3Fe0+2O20=Fe3 +2,+3O4 -2 железная окалина | |
| Взаимодействие со сложными веществами | |
| 1)скислотами, (растворами соляной и серной кислотой, с вытеснением водорода) работа с электрохимическим рядом напряжений металлов: восстановительная способность железа ниже, чем у щелочных и щелочно-земельных металлов и алюминия Fe 0+ 2H+1 Cl-1= Fe+2Cl2-1+ H2 0 | 1) с разбавленной азотнойкислотой, концентрированные азотная и серная кислота пассивируют железо, создавая на его поверхности защитную оксидную пленку Fe0 + 4H+1 N+5O-23= Fe+3(N+5 O-23)3 + N+2O-2 +2H2+1 О-2 Рассмотреть как ОВР, расставив коэффициенты методом электронного баланса. |
| 2)ссолями | |
| Fe0 + Cu +2S +6O -24 = Fe +2S +6O -24 + Cu0 Демонстрация опыта | |
| 3)с водой 3 Fe0 + 4H2 +1O-2 (пары) = Fe3 +2,+3O -24 + 4H20 железная окалина При температуре 700-900оС |