Твердые тела
Твердые тела бывают кристаллическими и аморфными.
Кристаллы
Кристаллы имеют правильную геометрическую форму, которая является результатом упорядоченного расположения частиц (атомов, ионов, молекул), составляющих кристалл.
Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой.
Точки, в которых расположены частицы, называются узлами кристаллической решетк и.
Если твердое тело образует единую кристаллическую решетку, то оно называется монокристаллом.
Характерной особенностью монокристаллов является их анизотропность - зависимость физических свойств от направления (анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки).
Если твердое тело состоит из множества беспорядоченно ориентированных мелких кристаллов, то оно называется поликристаллом.
Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента - элементарной ячейки.
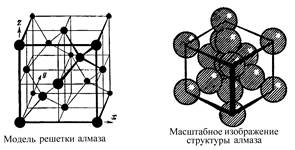
Классификация кристаллов
В зависимости от рода частиц в узлах решетки и характера химической связи между ними кристаллы разделяются на четыре типа:
· ионные (в узлах находятся ионы, силы взаимодействия между ионами являются электростатическими(кулоновскими), химическая связь носит ионный характер, типичный пример - кристалл NaCl),
· атомные (в узлах располагаются нейтральные атомы, химическая связь носит ковалентный характер, типичный пример - кристалл кремния),
· металлические (в узлах располагаются положительные ионы металла, а валентные электроны принадлежат всему кристаллу, образуя электронный газ, химическая связь носит металлический характер, типичный пример - кристаллы всех металлов),
· молекулярные (в узлах располагаются нейтральные молекулы, силы взаимодействия между ними обусловлены незначительным взаимным смещением электронов в атомах (Ван-дер-ваальсовы силы), типичный пример - кристаллы благородных газов и большинство органических веществ).
Расположение атомов в кристаллах характеризуют координационным числом - числом ближайших однотипных с данным атомом соседних атомов.
Дефекты кристаллов
В реальных кристаллах всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, которые называются дефектами кристаллической решетки.
Дефекты бывают макроскопическими (трещины, поры, инородные макровключения) и микроскопическими.
Микродефекты делятся на:
- вакансия - отсутствие атома в узле решетки;
- междоузельный атом - атом, внедрившийся в междоузельное пространство;
- примесный атом - атом примеси либо в узле решетки (примесь замещения), либо в междоузельном пространстве (примесь внедрения)
- линейные (краевая дислокация - когда одна атомная плоскость обрывается внутри кристалла; винтовая дислокация - когда атомные плоскости лишь приблизительно параллельны, так что кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности).
Фазовые переходы
Фаза - это термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Если система является однокомпонентной (т.е. состоит из химически однородного вещества), то понятие фазы совпадает с понятием агрегатного состояния.
Например, если в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза - вода, газообразная фаза - водяной пар.
Если в воду бросить кусок льда, то эта система станет трехфазной.
Переход вещества из одной фазы в другую - фазовый переход - всегда связан с качественными изменениями свойств вещества.
Примером фазового перехода служат изменения агрегатного состояния вещества (испарение, плавление) или переходы, связанные с изменением строения (переход кристаллического вещества из одной модификации в другую) или свойства вещества (переход металла в сверхпроводящее состояние).
Фазовый переход I рода сопровождается поглощением (выделением) теплоты (теплоты фазового перехода) и характеризуются постоянством температуры, изменениями энтропии и объема.
Типичные примеры - плавление, кристаллизация.
Фазовый переход II рода не связан с поглощением (выделением) теплоты и изменением объема, для него характерно постоянство объема и энтропии, но зато скачкообразно меняется теплоемкость.
Фазовые переходы II рода связаны с изменением симметрии; выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода.
Типичные примеры - переход ферромагнитных веществ (железо, никель) при определенной температуре и давлении в парамагнитное состояние; переход некоторых веществ при некоторой температуре в сверхпроводящее состояние.
Для наглядного изображения фазовых превращений в однокомпонентной системе используется диаграмма состояния, на которой задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих диаграмму на три области, соответствующих условиям существования твердой, жидкой и газообразной фаз.
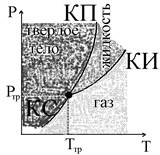
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП- твердого тела и жидкости, КИ - жидкости и газа, КС - твердого тела и газа.
Точка, в которой пересекаются эти кривые и которая определяет условия одновременного равновесного сосуществования трех фаз, называется тройной точкой.
Каждое вещество имеет только одну тройную точку (тройная точка воды соответствует температуре 273.16К = 0.01оС).
Плавление, испарение, конденсация, кристаллизация, сублимация.
Испарение и сублимация
В жидкостях и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее пространство.
Этот процесс для жидкостей называется испарением, а для твердых тел - сублимацией (возгонкой).
Испарение и сублимация идут при любой температуре, но их интенсивность возрастает с повышением температуры.
Плавление и кипение.
На рисунке показана температура тела в зависимости от количества теплоты, получаемой телом: по мере сообщения телу теплоты его температура повышается, а при температуре Тпл начинается переход тела из твердого состояния в жидкое - плавление.
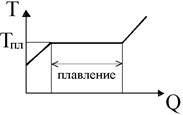
В процессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, а поэтому температура остается постоянной вплоть до расплавления всего кристалла.
Затем температура жидкости начнет повышаться: подводимая теплота пойдет опять на увеличение энергии частиц жидкости.
При достижении температуры Ткип температура вновь остается постоянной, а подводимая теплота идет на совершение работы по разрушению структурной сетки жидкости - идет процесс кипения.
Количество теплоты, необходимое для расплавления (испарения) 1 кг вещества называется удельной теплотой плавления (испарения).