Расчет кривой окислительно-восстановительного титрования
Рассчитаем кривую титрования 100 см3 раствора FeSO4 c молярной концентрацией эквивалента 0,1 моль/дм3 раствором КMnO4 такой же концентрации.
Уравнение реакции:

Константа равновесия этой реакции равна

Большое числовое значение константы равновесия показывает, что равновесие реакции практически целиком сдвинуто вправо. После добавления первых же капель титранта в растворе образуются две ОВ пары:  , потенциал каждой из которых можно вычислить по уравнению Нернста:
, потенциал каждой из которых можно вычислить по уравнению Нернста:
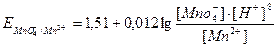

В данном случае раствор восстановителя титруется раствором окислителя, т.е. титрование относится к методу оксидиметрии, расчет кривой титрования проводим по соответствующей схеме.
1) До Т.Э. 






2) В Т.Э. 

3) После Т.Э. 





Расчетные данные для построения кривой титрования
| № п/п | τ | Расчетная формула | E, В |
| 0,10 | 
| 0,71 | |
| 0,50 | 0,77 | ||
| 0,90 | 0,83 | ||
| 0,99 | 0,89 | ||
| 0,999 | 0,95 | ||

| 1,39 | ||
| 1,001 | 
| 1,47 | |
| 1,01 | 1,49 | ||
| 1,10 | 1,50 | ||
| 1,50 | 1,505 |
По данным таблицы строим кривую титрования:

Для ошибки титрования ± 0,1 % скачок титрования
∆E = Eτ=1,001 - Eτ=0,999 = 1,47 – 0,95 = 0,52.
Для ошибки титрования ± 1,0 % скачок титрования
∆E = Eτ=1,01 - Eτ=0,99 = 1,49 – 0,89 = 0,60.
В области ТЭ при переходе от раствора недотитрованного на 0,1 % к раствору перетитрованному на 0,1 % потенциал изменяется больше, чем на 0,5 В. Скачок потенциала позволяет использовать для обнаружения ТЭ непосредственно потенциометрические измерения или ОВ индикаторы, окраска которых изменяется при изменении потенциала. Кроме того в этом случае в качестве титранта используется окрашенный раство, следовательно Т.Э. можно определить по появлению слабо-розовой окраски от одной избыточной капли перманганата калия.
Комплексометрия. Комплесонометрическое титрование
Комплесометрия основана на реакциях образования комплексов. Несмотря на их огромное разнообразие, метод не нашел широкого распространения, т.к. эти реакции проходят в несколько стадий. Из множества реакций применение в титриметрии нашли только реакции с участием ионов:
 1) Ртути (II) - меркурометрия
1) Ртути (II) - меркурометрия
(где Х = Cl-, Br-, J-, SCN-)
 2) CN- - цианометрия
2) CN- - цианометрия
3) F- - фторометрия
 |
 Для того, чтобы на кривой титрования получились скачки, соответствующие отдельным ступеням комплексообразования, необходимо выполнение условия дифференцированного титрования
Для того, чтобы на кривой титрования получились скачки, соответствующие отдельным ступеням комплексообразования, необходимо выполнение условия дифференцированного титрования
 где - константы равновесия реакции комплексообразования по I, II, III,… ступеням.
где - константы равновесия реакции комплексообразования по I, II, III,… ступеням.
Для большинства реакций коплексообразования различие между константами равновесия образования комплексов отдельных ступеней составляют 102 – 104. Для таких реакций получается кривая титрования с одним скачком титрования.
Широкое практическое применение метод комплексообразования нашел с открытием новых комплексообразователей – производных аминополикарбоновых кислот - комплексонов. Метод анализа с применением комплексонов получил название комплексонометрия.
Метод комплексонометрического титрования основан на реакциях образования внутрикомплексных соединений ионов металлов с комплексонами. Ионы металлов, участвующие в комплексообразовании, являются акцепторами электронных пар, тогда как аминополикарбоновые кислоты - их донорами.
Достоинствами метода являются:
- реакция одностадийная, протекает быстро, состав образующегося комплекса прост и отвечает соотношению металл-лиганд 1:1(для МоО22+ может быть 2:1);
- комплекс очень устойчив вследствие циклообразования (за счет энтропийного фактора) и хорошо растворим в воде.
С помощью комплексонов можно определить почти все металлы и этот метод начинает вытеснять осадительное титрование, гравиметрию, окислительно-восстановительное титрование.
Наиболее распространены 3 комплексона:
 |
нитрилотриуксусная кислота – комплексон I (Н3Y);
 |
этилендиаминтетрауксусная кислота (ЭДТА) – комплексон II (H4Y;)
 |
динатриевая соль ЭДТА - комплексон III (трилон Б).
Cокращенно пишут Na2H2Y4 · 2Н2О.
В связи с лучшей растворимостью в воде наиболее широкое практическое применение нашел трилон Б.
Образование трилоном Б внутрикомплексного соединения с каким-нибудь двухзарядным катионом происходит путем замещения металлом атомов водорода карбоксильных групп и одновременного взаимодействия катиона с атомами азота аминогрупп (за счет координационной связи):
 |
Такие реакции комплексообразования можно представить в виде: 
Повышение кислотности среды препятствует образованию комплекса МеY2¯, поэтомупри комплекс. титровании используют буферные растворы.
Чтобы реакция комплексообразования прошла с достаточной полнотой (99,99 %) и могла быть использована в количественном анализе константа образования комплекса должна быть больше 108. В этом случае остаточные концентрации [Ме2+] и [Y4¯] в момент эквивалентности не превышают 1·10-4 от единицы. Общая константа образования комплекса или устойчивость комплекса β выражается уравнением 
Устойчивость комплексов металл-ЭДТА различна в зависимости от природы иона металла, его зарядности и меняется в зависимости от рН среды. р- и d – элементы могут образовать комплексы с ЭДТА и в кислой среде. К ним относятся комплексы с Bi3+, Fe3+, Cr3+ и т.д. В то же время определение Ва2+, Mg2+, Cr2+ комплексонометрическим титрованием проводят в щелочной среде.
Как видно из уравненеия реакции комплексообразования. При титровании комплексоном III происходит выделение ионов водорода, для связывания которых в анализируемый раствор вводят буферный раствор.