Природный церий состоит из смеси четырёх стабильных изотопов: 136Ce (0,185%), 138Ce (0,251%), 140Ce (88,450%) и 142Ce (11,114%). Два из них (136Ce и 142Ce) в принципе могут испытывать двойной бета-распад, однако их радиоактивность не наблюдалась, установлены лишь нижние ограничения на периоды полураспада (3,8×1016 лет и 5,0×1016 лет, соответственно). Известны также 26 радионуклидов церия. Из них наиболее стабильны 144Ce (период полураспада 284,893 д), 139Ce (137,640 д) и 141Ce (32,501 д). Остальные известные радионуклиды церия имеют периоды полураспада менее 4 дней, а большинство из них - менее 10 минут. Известны также 2 изомерных состояния изотопов церия. [5]
Церий-144 (период полураспада 285 суток) является одним из продуктов деления урана-235, в связи с чем нарабатывается в больших количествах в ядерных реакторах. Максимальная энергия излучения бета частиц - 91 кэВ. Применяется в виде двуокиси (плотность около 6,4 г/см³) в производстве радиоизотопных источников тока в качестве источника тепла, его энерговыделение составляет около 12,5 Вт/см³. [1]
Методы определения. Определение содержания церия 144 в объектах окружающей среды проводят по гамма-, бета излучению на бета-гамма радиометрах или спектрометре. При радиохимическом определении в объектах внешней среды церия 141 и 144 основано на групповом осаждении изотопов редкоземельных элементов с носителем лантаном в виде оксалатов и гидроксидов с последующим разделением.
Радиоактивные изотопы церия получают в ядерном реакторе при делении ядер атомов тяжелых элементов или при ядерных взрывах. Содержание изотопов церия в неразделенной смеси продуктов деления составляют 6 %. [5]
Расчетная часть.
Исходные данные:
Состав раствора: «Ce(NO3)3 – Na3PO4 – Na2SO4 – KF – H2O»
C(Ce(NO3)3) = 10-6 моль/л
С(Na3PO4) = 0,01 моль/л
С(Na2SO4) = 0,2 моль/л
С(KF) = 0,02 моль/л
рН = 1-12
Основные реакции
1. Ce(NO3)3 ↔ Ce3+ + 3 NO3-
2. Na3PO4 ↔ 3 Na+ + PO43-
3. Na2SO4↔ 2 Na+ + SO42-
4. KF ↔ K+ + F-
Рассчитать долю и концентрацию форм состояния гидролизующихся лигандов в растворе во всем диапазоне рН; построить распределительную диаграмму для каждого из них.
1. Серная кислота:


т.к. серная кислота является сильной кислотой, то далее в расчетах примем что:  =
=  = 0,2 моль/л (по условию).
= 0,2 моль/л (по условию).
Фосфорная кислота
РО43- + НОН → НРО42- + ОН-
НРО42- + НОН → Н2РО4- + ОН-
Н2РО4- + НОН → Н3РО4 + ОН- 
Н3РО4 → Н+ + Н2РО4- k1d = 7.6*10-3
Н2РО4- → Н+ + НРО42- k2d = 6.2*10-8
НРО42- → Н+ + РО33- k3d = 4,2*10-13


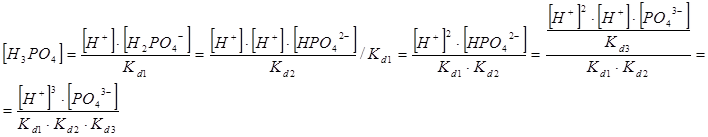


C(Na3PO4) =  +
+  +
+  +
+ 
Все члены равенства разделим на [PO43-] и получим:

 +
+ 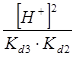 +
+ 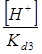 + 1
+ 1
 = C(Na3PO4) /
= C(Na3PO4) /  +
+  +
+ 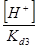 + 1
+ 1
Расчет концентраций ионов при рН = 1
C (Na 3 PO 4) = 0,01 моль / л

= 1,83 ∙ 10-21
[ HPO 42-] = (0,01 · 1,83 · 10-21) / 4,2 ∙ 10-13 = 4,37 ∙ 10-10
[ H 2 PO 4-] = (0,012 · 1,83 · 10-21) / (6,2 · 10-8 · 4,2 · 10-13) = 0,000706
[ H 3 PO 4] = (0,013 · 1,83 ∙ 10-21) / (7,6·10-3·6,2·10-8·4,2·10-13) = 0,009293
Табл. 1. Расчет концентрации ионов при C (Na 3 PO 4) = 0,01 моль / л
| рН | [PO4 3-] | [HPO4 2-] | [H2PO4-] | [H3PO4] | Проверка |
| 1,83926E-21 | 4,37918E-10 | 0,00070632 | 0,00929368 | 0,01 | |
| 1,12445E-18 | 2,67727E-08 | 0,00431817 | 0,005681803 | 0,01 | |
| 2,30108E-16 | 5,47877E-07 | 0,008836725 | 0,001162727 | 0,01 | |
| 2,56861E-14 | 6,11574E-06 | 0,009864094 | 0,000129791 | 0,01 | |
| 2,58457E-12 | 6,15375E-05 | 0,009925403 | 1,30597E-05 | 0,01 | |
| 2,45167E-10 | 0,000583732 | 0,009415029 | 1,23882E-06 | 0,01 | |
| 1,60739E-08 | 0,003827123 | 0,006172779 | 8,12208E-08 | 0,01 | |
| 3,61654E-07 | 0,008610798 | 0,001388838 | 1,82742E-09 | 0,01 | |
| 4,13163E-06 | 0,009837204 | 0,000158665 | 2,08769E-11 | 0,01 | |
| 4,17573E-05 | 0,009942207 | 1,60358E-05 | 2,10998E-13 | 0,01 | |
| 0,000403009 | 0,009595444 | 1,54765E-06 | 2,03638E-15 | 0,01 | |
| 0,002957713 | 0,007042174 | 1,13583E-07 | 1,49452E-17 | 0,01 |
Рассчитаем доли ионов α.




рН = 1
α(PO 43-) = 1,84 * 10-21 / 0,01 = 1,83 * 10-19
α(HPO 42-) = 4,37 * 10-10 / 0,01 = 4,37 * 10-8
α(H 2 PO 4-) = 0,0007063 / 0,01 = 0,0706
α(H 3 PO 4) = 0,0092937 / 0,01 = 0,9294
Табл. 2. Расчет доли ионов α при C (Na 3 PO 4) = 0,01 моль / л
| рН | α[PO4 3-] | α[HPO4 2-] | α[H2PO4 -] | α[H3PO4] | Проверка |
| 1,83926E-19 | 4,37918E-08 | 0,070631967 | 0,929367989 | ||
| 1,12445E-16 | 2,67727E-06 | 0,431817026 | 0,568180297 | ||
| 2,30108E-14 | 5,47877E-05 | 0,883672513 | 0,116272699 | ||
| 2,56861E-12 | 0,000611574 | 0,986409356 | 0,01297907 | ||
| 2,58457E-10 | 0,00615375 | 0,992540276 | 0,001305974 | ||
| 2,45167E-08 | 0,058373181 | 0,941502913 | 0,000123882 | ||
| 1,60739E-06 | 0,382712326 | 0,617277945 | 8,12208E-06 | ||
| 3,61654E-05 | 0,861079811 | 0,138883841 | 1,82742E-07 | ||
| 0,000413163 | 0,983720378 | 0,015866458 | 2,08769E-09 | ||
| 0,004175727 | 0,994220691 | 0,001603582 | 2,10998E-11 | ||
| 0,040300864 | 0,959544371 | 0,000154765 | 2,03638E-13 | ||
| 0,295771288 | 0,704217353 | 1,13583E-05 | 1,49452E-15 |
Диаграмма 1. Зависимость α (PO 43-, HPO 42-, H 2 PO 4-, H 3 PO 4) от рН раствора C (Na 3 PO 4) = 0,01 моль / л

3. Фтороводородная кислота
HF ↔ H+ + F-

Kd4 = 6.9∙10-4

C(KF) = [HF] + [F-] =  =
= 

Табл. 3. Расчет концентрации и доли ионов при C (KF) = 0,02 моль / л
| pH | [F-] | α[F-] |
| 0,017222222 | 0,861111111 | |
| 0,01968254 | 0,984126984 | |
| 0,019967794 | 0,998389694 | |
| 0,019996775 | 0,999838736 | |
| 0,019999677 | 0,999983871 | |
| 0,019999968 | 0,999998387 | |
| 0,019999997 | 0,999999839 | |
| 0,02 | 0,999999984 | |
| 0,02 | 0,999999998 | |
| 0,02 | ||
| 0,02 | ||
| 0,02 |