Определение.
Амины в природе образуются при гниении живых организмов. Амины – это производные аммиака, в молекулах которого один, два или три атома водорода замещены на углеводородные радикалы Общая формула – R-NH2.
Классификация аминов.
В зависимости от радикала, амины бывают
– предельные
– непредельные СН2 = СН–NН2;
– ароматические С6Н5–NН2.
В зависимости от строения аминогруппы, бывают
– первичные R-NH2. Например: СН3–NН2, СН3–СН2–СН2–СН2 –NН2
– вторичные R-NH-R1. Например: СН3–NН–С2Н5
– третичные RN(R1)R2. Например: СН3–N(СН3)–СН3
Номенклатура и изомерия.
Названия даются путем перечисления радикалов с добавлением слова амин
Например:
СН3 – NН2 метиламин;
СН3 – NН–С2Н5 метилэтиламин;
СН3 – N(СН3)–СН3 триметиламин;
С6 Н5 – NН2 фениламин.
Различные радикалы перечисляются в алфавитном порядке.
Например: CH3-CH2-NH-CH3 метилэтиламин.
При наличии одинаковых радикалов используют приставки ди и три.
Например: (CH3)2NH диметиламин.
Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В таком случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) с добавлением цифр, отражающих положение этих групп в углеродной цепи. Например:3 2 1

Физические свойства.
С1– С3 газы, с запахом аммиака.
С4– С9 жидкости сзапахом тухлой рыбы, хорошо растворяются в воде.
С10 твердые, нерастворимые вещества в воде, не имеющие запаха.
Химические свойства.
Взаимодействие с водой:
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму).
CH3 – NH2 + HOH = CH3 – NH3OH (CH3 – NH3 + + OH-)
(гидроксид метиламмония)
Амины являются более сильными основаниями, чем аммиак из-за влияния радикалов на атом азота. По этой причине амины взаимодействуют с кислотами.
Взаимодействие с кислотами
CH3 – NH2 + HCl = CH3 – NH3 Cl
(хлорид метиламмония)
Реакция горение
4CH3 – NH2 +9O2 =2N2 +10H2O +4СО2.
Применение аминов.
Амины используют при получении лекарственных веществ, полиамидных волокон, красителей, для вулканизации каучука.
Свойства аминов.
Основные свойства аминов предельного ряда выражены сильнее. Слабые основные свойства ароматических аминов объясняется влиянием групп атомов в органических веществах, например, бензольного кольца на аминогруппу. Бензольное кольцо притягивает к себе электроны атома азота, уменьшая электронную плотность на атоме азота, следовательно, уменьшается способность присоединения протона (катиона) водорода и основные свойства уменьшаются.
СН3NH2 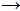 NH3
NH3 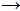 C6H5NH2
C6H5NH2
Отдельные представители.
Анилин (фениламин) С6H5NH2 – ароматический амин. Анилин это бесцветная маслянистая жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. Анилин широко применяется в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
История открытия анилина. Унфердорбен, химик в Даме (Саксония) нашел в 1826 г. между продуктами сухой перегонки индиго маслообразное вещество, названное им кристалином.
Несколько лет спустя Рунге в Берлине открыл в каменноугольном дегте соединение, дающее с хлорной известью фиолетовое окрашивание, дал ему название цианода (голубого масла).
Поздние, академик Фрицше в Петербурге, изучал соединения, нашел маслообразное вещество которое назвал анилином, (от португальского названия индиго – “Anil”).
В 1842 г. знаменитому русскому химику Н. Н. Зинину удалось из бензола, заключающегося в каменноугольном дегте, получить восстановлением нитробензола маслообразное тело, названное им бензидамом.
В 1843 г. Гофман показал, что четыре тела: кристалин, цианол, анилин и бензидам тождественны между собою и дал название – анилин.
Получение анилина (реакция Зинина):
С6Н5–NО2+6Н 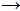 С6Н5–NН2 + 2Н2О
С6Н5–NН2 + 2Н2О
3. Обобщение материала.(второй блок)
Составить уравнения реакций по схеме:
Хлорметан – метанол – метиламин – бромид метиламмония
(третий блок)
Задача:
Смешали 10 л газообразного метиламина (н.у.) и 10 г хлороводорода. Какая масса кристаллического хлорида метиламмония при этом образовалась? Какой газ и в каком объеме остался в колбе после окончания реакции?
4. Домашнее задание. Повторить конспект.
5. Литература: учебник Химия 10 класс, О.С.Габриелян, И.Г.Остроумов, С.А.Сладков. базовый уровень, М. «Просвещение» 2018г