22.10.20.
Итак, кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. При мысленном соединении этих точек линиями получаются пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. Как мы уже знаем, в узлах могут находиться ионы, атомы или молекулы. Эти частицы колеблются в узлах решетки около своего положения равновесия. Если кристалл нагревать, амплитуда (размах) колебаний возрастает и кристаллическое тело расширяется.
К каждой частице, находящейся в кристалле, примыкает вплотную только определенное число соседних частиц. Это число ближайших соседних частиц называется координационным числом.
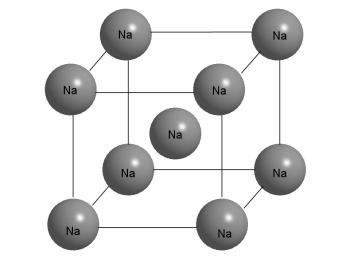
Например, в металлическом кристалле натрия (повторяем здесь рис. 3-13 из предыдущего параграфа) каждый ион натрия окружен восемью ближайшими соседями – на рисунке это особенно хорошо видно по атому, который помещен в центр куба. Но в металле все атомы натрия равноценны и имеют одинаковое окружение. Таким образом, координационное число натрия в металлическом кристалле равно 8.
Точно такое же координационное число у ионов цезия и хлора в кристалле CsCl. Кристалл CsCl построен как бы из вложенных друг в друга кубиков двух разных сортов. Например, можно нарисовать кубик с вершинами из ионов цезия, и тогда в центре окажется ион хлора (как на рис. 3-20). Но если вы представите 8 ионов хлора и мысленно соедините их линиями, то получится кубик с вершинами из ионов хлора, в центре которого окажется ион цезия.
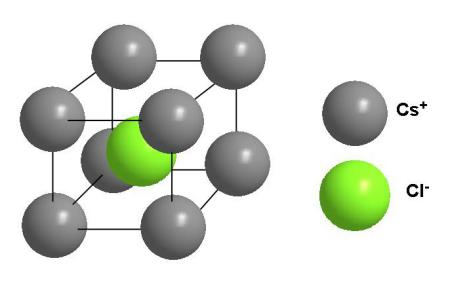
Рис. 3-20. Строение кристалла хлористого цезия CsCl. Координационное число 8 по цезию и по хлору.
Чаще всего кристаллические решетки изображают таким образом, чтобы показать только взаимное расположение частиц, но не их размеры. Если продолжить рисование кристаллической решетки CsCl, то обнаружится, что она состоит из повторяющихся одинаковых структурных единиц - "кирпичиков". Такая структурная единица называется элементарной ячейкой.
Чтобы правильно нарисовать элементарную ячейку, надо поместить в ее центр любую частицу и расположить вокруг нее только ближайшие соседние частицы в соответствии с координационным числом. Неопытный химик (но не мы!) при рассматривании элементарной ячейки кристалла CsCl (рис. 3-20) может прийти к выводу, что в соединении на один атом хлора приходится 8 атомов цезия (или наоборот, если нарисовать ячейку с атомом цезия в середине). Но мы с вами знаем, что это не так: в соединении CsCl соотношение цезия и хлора 1:1, а элементарная ячейка служит для описания структурных особенностей кристалла, а не состава соединения.
Для кристалла NaCl, где координационное число 6 как для катиона, так и для аниона, элементарная ячейка будет выглядеть иначе (рис. 3-21). Каждой элементарной ячейке соответствует свой способ плотной упаковки.
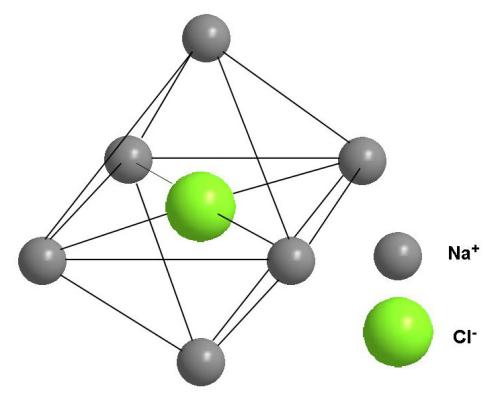
Рис. 3-21. Элементарная ячейка кристалла NaCl. Координационное число 6 по натрию и по хлору.
Элементарной ячейке NaCl соответствует гранецентрированная кубическая упаковка, а рассмотренной выше ячейке кристалла CsCl – объемноцентрированная кубическая упаковка. Названия упаковок говорят сами за себя: у гранецентрированной есть частица в центре каждой грани куба, а у объемноцентрированной – частица находится в центре куба.
Существуют и другие способы плотной упаковки. Интересно, что виды плотных упаковок и элементарных ячеек универсальны, то есть могут встречаться в любых кристаллах - ионных, молекулярных и т.д. От способа плотной упаковки зависит форма кристалла. А цвет, прочность, температура плавления и многие другие физические свойства зависят от частиц, которые составляют кристаллическую решетку и способа их связывания друг с другом.
 Это порождает многообразие форм кристаллов, которые нередко очень красивы. Чтобы кристалл "показал" свою настоящую форму, он должен быть монокристаллом - то есть одним кристаллом, во всем объеме которого кристаллическая решетка не имеет дефектов. Большинство кристаллов, с которыми мы сталкиваемся в быту (поваренная соль) - это поликристаллы, то есть множество сросшихся мелких кристаллов, которые по внешнему виду иногда трудно отличить от обычного порошка какого-нибудь аморфного (не кристаллического) соединения. В горных минералах монокристаллы встречаются потому, что природа имела достаточно времени для выращивания таких кристаллов буквально по "частичке" - из расплавов или растворов глубоко в недрах Земли, где температура, давление и другие внешние условия менялись очень медленно. На фотографии вы видите несколько сросшихся монокристаллов горного хрусталя.
Это порождает многообразие форм кристаллов, которые нередко очень красивы. Чтобы кристалл "показал" свою настоящую форму, он должен быть монокристаллом - то есть одним кристаллом, во всем объеме которого кристаллическая решетка не имеет дефектов. Большинство кристаллов, с которыми мы сталкиваемся в быту (поваренная соль) - это поликристаллы, то есть множество сросшихся мелких кристаллов, которые по внешнему виду иногда трудно отличить от обычного порошка какого-нибудь аморфного (не кристаллического) соединения. В горных минералах монокристаллы встречаются потому, что природа имела достаточно времени для выращивания таких кристаллов буквально по "частичке" - из расплавов или растворов глубоко в недрах Земли, где температура, давление и другие внешние условия менялись очень медленно. На фотографии вы видите несколько сросшихся монокристаллов горного хрусталя.
Мир кристаллов настолько красив, что даже обычно сдержанные ученые-химики иногда описывают его не сухим языком научных статей, а скорее поэтическими категориями. Посмотрите, с каким восхищением пишет о строении кристаллов норвежский химик Юхан Фогт:
 "Представьте себе двести замечательных скрипачей, играющих одну и ту же пьесу на прекрасно настроенных инструментах, но не в унисон. Результат будет не из приятных, и даже человек с хорошим слухом не поймет, что они играют. Аналогичную музыку издают молекулы газов, жидкостей и обычных твердых тел... В отличие от этого кристалл подобен оркестру, руководимому блестящим дирижером; за движениями дирижера следят глаза всех музыкантов, и все смычки повинуются каждому мановению его руки... Для меня музыка физических законов звучит самым полным и сильным аккордом именно в области науки о кристаллах".
"Представьте себе двести замечательных скрипачей, играющих одну и ту же пьесу на прекрасно настроенных инструментах, но не в унисон. Результат будет не из приятных, и даже человек с хорошим слухом не поймет, что они играют. Аналогичную музыку издают молекулы газов, жидкостей и обычных твердых тел... В отличие от этого кристалл подобен оркестру, руководимому блестящим дирижером; за движениями дирижера следят глаза всех музыкантов, и все смычки повинуются каждому мановению его руки... Для меня музыка физических законов звучит самым полным и сильным аккордом именно в области науки о кристаллах".
Д/З: Составить конспект