Изомеры – соединения с одинаковым качественным и
количественным составом, но отличающиеся по строению и
обладающие поэтому различными физическими, химическими
или биологическими свойствами.
Различают структурную и пространственную (стерео -) изомерию.
Три вида структурной изомерии:
1) изомерия углеродного скелета: например, пентан, 2-метилбутан, 2,2-диметилпропан (рис.2); 2) изомерия положения функциональных групп или кратных связей: например, 2-бутен и 1-бутен; или 1-пропанол и 2-пропанол (рис. 3);
3) изомерия функциональной группы: например, диметиловый эфир и этанол (рис. 4):
 | |||
 | |||
Рисунок 3. Изомерия положения функциональ
ных групп или кратных связей
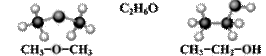 |
Рисунок 2. Изомерия углеродного скелета Рисунок 4. Изомерия функциональной группы
Для карбоновых кислот изомерами по функциональной группе являются сложные эфиры, для альдегидов – кетоны, для спиртов – простые эфиры, для аминокислот – сложные эфиры, амиды гидроксикислот и нитросоединения (рис. 5).

Рисунок 5. Примеры изомеров по функциональной группе (межклассовых изомеров)
Стереоизомеры (пространственные изомеры) – это соединения, в молекулах которых имеется одинаковая последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
 К пространственным изомерам относят
К пространственным изомерам относят
геометрические (цис-транс-) изомеры, например
цис-2-бутен и транс-2-бутен, отличающиеся
расположением заместителей относительно
|
 двойной связью:
двойной связью:
Важный вид пространственной изомерии – энантиомерия (оптическая
или зеркальная изомерия).
Признаки оптической активности органических соединений:
– наличие асимметрического атома углерода;
– отсутствие в молекуле элементов симметрии.
Асимметрический атом углерода — атом, связанный с четырьмя
различными атомами или группами.
Оптически активные соединения образуют два пространственных изомера, являющихся зеркальными отражениями друг друга (энантиомеры).
Энантиомеры обладают одинаковыми физическими и химическими свойствами, но вращают плоскость поляризации плоскополяризованного света в противоположные стороны, они в пространстве несовместимы друг с другом. Наглядным примером несовместимости предмета и его зеркального изображения служит невозможность надеть на левую руку правую перчатку, соответствующую пространственному расположению правой руки.
Смесь, состоящая из равных мольных количеств энантиомеров, называется рацемической смесью или рацематом. Рацемат оптически не активен.

 Чтобы правильно изобразить конфигурацию энантиомеров, углеродную цепь молекулы изображают вертикально, старший заместитель при этом располагается вверху; заместители у асимметрического атома углерода располагают слева и справа от углеродной оси:
Чтобы правильно изобразить конфигурацию энантиомеров, углеродную цепь молекулы изображают вертикально, старший заместитель при этом располагается вверху; заместители у асимметрического атома углерода располагают слева и справа от углеродной оси:
 Если функциональная группа (в молочной кислоте – гидроксильная) располагается слева от углеродной оси, изомер относят к L-ряду, если справа – к D-ряду Асимметрический атом углерода часто не обозначают химическим символом, он подразумевается в пересечении линий, показывающих соответствующие связи.
Если функциональная группа (в молочной кислоте – гидроксильная) располагается слева от углеродной оси, изомер относят к L-ряду, если справа – к D-ряду Асимметрический атом углерода часто не обозначают химическим символом, он подразумевается в пересечении линий, показывающих соответствующие связи.
Несмотряна одинаковые физические и химические свойства, биологи-
ческая активность энантиомеров может быть совершенно различной. Так,
в состав белков входят только L-аминокислоты. Биоактивность энантиоме-
ров необходимо учитывать и при создании лекарств во избежание таких
трагедий, как с талидомидом, широко применявшимся в 60-е годы XX в.
беременными женщинами как эффективное снотворное и успокаивающее.
Со временем проявилось его тератогенное действие, и на свет появилось много младенцев с врожденными уродствами (рис. 6). Талидомид был запрещён. Но лишь в конце 80-х годов выяснилось, что причиной несчастий стал только один из энантиомеров талидомида. О таком различии в действии лекарственных форм не знали, а талидомид был рацемической смесью.
 |  |  | |||
Рисунок 6. Жертвы талидомида и памятник в Лондоне
Жертвам талидомида в Лондоне в 2005 году установлен памятник. В качестве модели для памятника выступала Элисон Леппер, которая на момент создания скульптуры была беременна. Ее ребенок, к счастью, вырос здоровым.
Часто только один из энантиомеров обладает требуемым терапевтическим эффектом, второй в лучшем случае бесполезен, а в худшем вызывает нежелательные побочные эффекты или токсичен. «Правильное» лекарство подходит к своему рецептору, как ключ к замку, и запускает желаемую биохимическую реакцию. Антиаритмическое средство L -анаприлин действует в сто раз сильнее, чем D -форма. У антигельминтного препарата левамизола активен в основном L -изомер, D- изомер вызывает тошноту. В 60-е годы одним из предшественников адреналина в организме – диоксифенилаланином (L -ДОФА) пытались лечить паркинсонизм. При этом выяснилось, что это вещество эффективно только в виде L -изомера. В то же время D -ДОФА вызывает серьезные побочные эффекты, в том числе заболевание крови.
Пеницилламин (3,3-диметилцистеин) применяют при острых и хронических отравлениях тяжелыми металлами, так как оно дает прочные комплексы с ионами этих металлов, и эти комплексы удаляются почками. Применяют пеницилламин также при различных формах ревматоидного артрита, при системной склеродермии, в ряде других случаев. При этом применяют только L -форму препарата, так как D -изомер токсичен и может привести к слепоте.
D-адреналин в десятки раз более активен, чем L-изомер.
Каждый энантиомер может обладать своим специфическим действием. Так, L -тироксин – стимулирует метаболизм белков и рост, а D -тироксин понижает содержание холестерина в крови. Некоторые производители придумывают для подобных случаев торговые названия-палиндромы, например «Darvon » для анальгетика и «Novrad» для противокашлевого препарата.
А вот противомалярийная активность D- и L- хингаминов одинакова.
Сопряженные системы
Различают два типа сопряженных систем (и сопряжений).
1. p, p-Сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в молекуле бутадиена СН2=СН–СН=СН2
В молекуле бензола делокализация происходит с участием 6 атомов углерода (три двойные связи, каждую образует 2 электрона, по одному от каждого атома).
2. р, p-Сопряжение — в делокализации принимают участие электроны p-связи и р-орбитали гетероатома; например, в молекуле пиррола, где в сопряжении участвуют пять атомов (4 атома С и атом N). Чем длиннее система сопряжения, тем более она устойчива.
Правило Хюккеля: ароматическая система представляет собой устойчивую плоскую циклическую сопряженную полиеновую структуру, содержащую (4 п + 2) p-электронов (п = 1, 2...). Так, бензол – ароматическая структура (6 p-электронов), а 1,3,5,7-циклооктатетраен – неароматическая структура (8 p-электронов).
Делокализация электронов – один из факторов повышения устойчивости молекул, поэтому это явление широко распространено в биологически важных молекулах (гетероциклические основания в нуклеиновых кислотах, витамины, гем, хлорофилл, гемоглобин и др.).