Вещество может адсорбироваться на поверхности раздела фаз, если его присутствие в межфазном слое уравнивает разность полярностей этих фаз в зоне их контакта.
Типы адсорбции:
· адсорбция на границе жидкость-газ
· адсорбция на границе твердое тело-газ
· адсорбция на границе твердое тело-жидкость (раствор)
Все самопроизвольные процессы на границах раздела фаз происходят в направлении уменьшения свободной поверхностной энергии.
ΔG=ΔH-TΔS ˂0
(ΔH –теплота адсорбции (мера интенсивности взаимодействия адсорбата с поверхностью адсорбента))
Следовательно, положительная адсорбция, приводящая к повышению концентрации вещества в пограничном слое, возможна только в том случае, если при этом уменьшается величина поверхностного натяжения (σ).
Взаимосвязь поверхностного натяжения растворов с адсорбцией на границе раздела жидкость-газ.
Поверхностное натяжение растворов зависит от:
· природы растворителя и растворенного вещества,
· концентрации растворенного вещества,
· температуры.
Зависимость поверхностного натяжения растворов при постоянной температуре от концентрации растворенного вещества называют изотермой поверхностного натяжения.
Растворенные вещества:
или понижают поверхностное натяжение растворителя (σрр<σо), и в таком случае их называют поверхностно-активными веществами (ПАВ) (по отношению к воде поверхностно-активными веществами являются многие полярные органические соединения: жирные кислоты, соли жирных кислот (мыла), сульфокислоты, сложные эфиры, белки и др.)
или повышают поверхностное натяжение растворителя (σрр<σо) – поверхностно-инактивные вещества (по отношению к воде поверхностно-инактивными веществами являются неорганические кислоты, основания, соли),
или не влияют на величину поверхностного натяжения растворителя (σрр=σо) (по отношению к воде поверхностно-неактивными веществами является сахароза и др.).
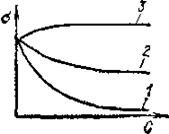
На изотерме поверхностного натяжения растворов:
σ - поверхностное натяжение,
С - концентрация раствора.
1, 2 - растворы поверхностно-активных веществ (ПАВ) с большей (1) и меньшей (2) поверхностной активностью;
3 - раствор поверхностно-активного вещества,
Поверхностно-активные вещества обычно обладают низким поверхностным натяжением. Характерной особенностью строения молекул ПАВ является их дифильность (двойственность). Молекулы ПАВ состоят из двух частей – полярной группы (-ОН, -NН2, -СООН) и неполярного углеводородного радикала. Обладающая значительным моментом полярная группа хорошо гидратируется и обуславливает сродство ПАВ к воде (гидрофильность). Гидрофобный (имеющий малое сродство к воде) углеводородный радикал является причиной пониженной растворимости этих соединений. Схематически строение молекулы ПАВ изображается

Поверхностная активность дифильных молекул зависит от длины углеводородного радикала. П.Дюкло и Траубе пришли к выводу, что их поверхностная активность с удлинением углеводородного радикала на группу – СН2 повышается в 3-3,5 раза. Подобным закономерностям подчиняются и другие гомологические ряды поверхностно-активных веществ.
Кривые зависимости поверхностного натяжения от концентрации ПАВ для алифатических кислот приведены:

В ряде случаев биологическая активность, например, наркотическое действие, бактерицидность и других веществ одного и того гомологического ряда возрастает с увеличением их поверхностной активности, т.е. в соответствии с правилом Дюкло-Граубе.
ПАВ, как и все вещества в зависимости от способности к диссоциации, делят на электролиты (поногенные ПАВ) и неэлектролиты (непоногонные ПАВ). Ионогенные ПАВ подразделяются на катионоактивные, анионоактивные и амфотерные. Катионные и анионные ПАВ применяют в хирургии в качестве антисептиков. Например, четвертичные аммониевые соединения приблизительно в 300 раз эффективнее фенола по губительному действию по отношению к микроорганизмам. Анионные и катионные ПАВ по длине алкильного радикала от С8 до С14 обладают ярко выраженной антифаговой активностью. Антимикробное действие ПАВ связывают с их влиянием на проницаемость клеточных мембран, а также ингибирующим действием на ферментативные системы микроорганизмов.
Проявление поверхностно-активных или поверхностно-неактивных свойств определенными веществами можно объяснить на основе адсорбционных явлений.
В продолжении (Взаимосвязь поверхностного натяжения растворов с адсорбцией на границе раздела жидкость-газ.)
Количественные характеристики адсорбции
Разность концентраций растворенного вещества в поверхностном слое и в таком же слое внутри объема раствора называют поверхностным избытком этого вещества и обозначают греческой буквой Г («гамма»).
Фундаментальное уравнение адсорбции Гиббса.

С –исходная концентрация вещества
dс –изменение концентрации ПАВ
dσ –изменение поверхностного натяжения
Г –гамма, избыток и недостаток вещества в поверхностном слое жидкости, моль/м2
R-универсальная газовая постоянная
ПАВ положительно адсорбируются в поверхностном слое и, следовательно, для них Г > 0, поскольку это приводит к уменьшению поверхностного натяжения.
Напротив, поверхностно-инактивные вещества адсорбируются отрицательно, т. е. их концентрация в поверхностном слое меньше, чем в объеме раствора (Г<0). При этом поверхностное натяжение несколько возрастает в результате того, что в растворах сильных электролитов поверхностные молекулы воды втягиваются внутрь раствора с большей силой, чем в чистой воде.
Пример изотермы поверхностного избытка в растворах поверхностно- активного вещества:

Структура поверхностного слоя: а — чистый растворитель; б — ненасыщенный мономолекулярный слой ПАВ; в — насыщенный мономолекулярный слой ПАВ.
Анализ уравнения изотермы Гиббса показывает, что при малых концентрациях ПАВ адсорбция пропорциональна С, при высоких – достигает предельного значения Г≈ и в дальнейшем не изменяется. При этом величина Г≈ постоянна для всех членов гомологического ряда. Существование этой предельной величины легко объяснить. Действительно, тонкий поверхностный слой при высоких концентрациях ПАВ в растворе должен насыщать его молекулы. Однако факт Г≈ для всех членов ряда на первый взгляд удивителен, так как он означает, что на 1см2 площади поверхностного слоя помещается одно и то же максимальное количество адсорбированных молекул, независимо от их длины. На основании этого факта, установленного экспериментально, а также других данных о свойствах поверхностных слоев и, в частности, основываясь на исследованиях русских ученых Б.И. Шишковского и Л.Г. Гурвича, американский ученый И. Ленгмюр выдвинул предложение об ориентации адсорбированных молекул в поверхностном слое. Он сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции дифильных молекул их полярные группы, обладающие большим сродством к полярной среде – воде, втягиваются в воду, в то время, как полярные радикалы выталкиваются в неполярную фазу.
При малых концентрациях ПАВ углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярные группы погружены в воду (а):

Такое их расположение возможно в результате гибкости углеводородной цепи. С повышением концентрации ПАВ количество молекул в поверхностном слое увеличивается, цепи поднимаются и при Г приобретают вертикальное положение (рис. б). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой мономолекулярным слоем поверхностно-активного вещества (рис.в). Величина Г при этом уменьшается, приближаясь к значению, характерному для чистого жидкого ПАВ на границе с воздухом. Существование такого плотно упакованного мономолекулярного слоя («молекулярного частокола») хорошо согласуется с фактом постоянства Г для всех членов гомологического ряда. Действительно, при вертикальной ориентации изменение длины цепи не изменяет площади, занятой молекулой в поверхностном слое, а следовательно, количества молекул, приходящихся на единицу площади, которое пропорционально Г.
Молекулы веществ с преобладанием гидрофобных свойств располагаются в основном на поверхности воды, образуя поверхностные пленки. Поверхностная пленка образуется мономолекулярным слоем молекул, каждая из которых занимает на поверхности воды определенную площадь. Толщину слоя и площадь, занимаемую каждой молекулой, можно рассчитать.
Так, в случае предельной адсорбции и образования мономолекулярной пленки на 1 см2 поверхностного слоя адсорбируется Г молей вещества, т.е. Г – NА молекул (NА – число Авогадро). Следовательно, площадь S, занимаемая одной молекулой, равна

______
Толщину слоя (длину молекулы) находят рассчитав массу вещества на 1 см2. Масса m вещества равна
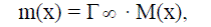
т.е. произведению величины максимальной адсорбции на молярную массу ПАВ.
Тогда длина молекулы ПАВ в насыщенном адсорбционном слое, равная толщине этого слоя е, может быть вычислена с помощью уравнения:

где ρ – плотность раствора ПАВ, кг/м2, Г͚ – предельная адсорбция; м – молярная масса, кг/моль.
Принцип независимости поверхностного действия лежит в основе экспериментальных и теоретических работ по созданию моделей биологических мембран. Согласно современным представлениям, в мембране имеются два слоя молекул фосфолипидов, которые гидрофильными концами направлены наружу, а гидрофобными – к центру мембраны. Модели строения биологической мембраны:

а) – по Данизли и Давсону: 1 – липидный бислой; 2 – мономолекулярный слой белков;
б) – мозаичная модель: 1 - липидный бислой; 2 – поверхностный слой белков; 3 – интегральные белки; 4 – ионный канал.
Согласно общепринятой модели биологической мембраны Ф.Даниэли и Т.Давсона (1931-1933) основным элементом мембранных структур клетки является бимолекулярный слой из молекул липидов, полярные группировки которых направлены наружу, а неполярные углеводородные радикалы – внутрь (рис.а). Полярные группы взаимодействуют с белками. Даниэли и Давсон предполагали, что белки образуют симметричные мономолекулярные слои на внешней и внутренней стороне липидного бислоя. Позднее было установлено ассиметрическое распределение белков в клеточных мембранах. Среди мембранных белков имеются такие, которые способны взаимодействовать с гидрофобными радикалами и проникать вглубь мембраны (интегральные белки). Так как часть поверхности мембраны свободна от белков, наиболее принятой является мозаичная модель мембраны (рис.б). Макромолекулы интегральных белков, пронизывающие мембрану, могут образовывать поры – ионные каналы, которые обладают избирательной проницаемостью для различных ионов. Большинство веществ, входящих в состав живого организма, являются поверхностно-активными. Они принимают участие во многих физиологических процессах. Например, на процесс усвоения жиров влияют соли желчных кислот, которые, обладая очень низким поверхностным натяжением, являются прекрасными эмульгаторами жиров. Жиры в виде эмульсий легко усваиваются.
Поверхностно-активные вещества широко применяются в фармакологии. Они используются в качестве основ для приготовления свечей и мазей, стабилизации эмульсий и в качестве солюбилизаторов. Солюбилизация - представляет собой растворение органических веществ в углеводородной части мицеллы ПАВ. В настоящее время известны солюбилизированные препараты жирорастворимых витаминов, гормонов, и других лекарственных веществ.
Аналогично изменяется пограничное натяжение и происходит адсорбция третьего компонента на границе двух несмешивающихся жидкостей.
Адсорбция на поверхности твердого тела
Твердые адсорбенты – природные и искусственные материалы с большой площадью поверхности. Различают:
Непористые сорбенты – обладают большой наружной поверхностью. Это высокодисперсные порошки – углеродная сажа, высокодисперсный кремнезем – белая сажа. Площадь их поверхности огромна – от несколько десятков до несколько сотен и тысяч квадратных метров на 1гр. вещества содержит до 1016 частиц в 1гр. вещества.
Пористые сорбенты – крупнодисперсные частицы, гранулы и т.д. Они имеют разветвленную внутреннюю поверхность. Это угольные сорбенты, силикагели, алюмосиликаты.
Адсорбция газов и паров на поверхности твердых тел тоже происходит в результате уменьшения свободной поверхностной энергии. Ввиду трудности измерения поверхностного натяжения твердых тел, об адсорбции на них судят, непосредственно определяя количество адсорбированного вещества. Последнее тем больше, чем больше поверхность адсорбента. Поэтому для осуществления адсорбционных процессов весьма важно создание высокопористых адсорбентов с развитой внутренней поверхностью, которую характеризуют удельной поверхностью, т. е. поверхностью, приходящейся на 1 г сорбента. Важнейшими пористыми сорбентами являются активный уголь и силикагель. Поглощающая способность подмечена еще в 18 веке. Современные методы получения и исследования активных углей в нашей стране разработаны М. М. Дубининым. Удельная поверхность активных углей достигает 1000 м2 на грамм. Активный уголь является гидрофобным адсорбентом, плохо поглощает пары воды и очень хорошо — углеводороды.
Для поглощения паров воды широко применяют гидрофильный адсорбент, представляющий собой аэрогель обезвоженной кремниевой кислоты и получивший название силикагеля. Промышленность изготовляет ряд марок силикагеля с различным размером и распределением пор.
Механизмы адсорбции на поверхности твердого тела окончательно не выяснены, однако имеется ряд более или менее доказанных положений, формулированных в основном Ленгмюром, Поляни, Брунауэром и др.
1. Адсорбционной активностью обладает не вся поверхность сорбента, а лишь его определенные участки – активные центры. В активных центрах имеются некомпенсированные химические связи – дефекты кристаллической решетки, группы атомов с неравномерным распределением электронной плотности или группы, способные к ионному обмену.
2. Адсорбционные силы действуют на малых расстояниях. Обычно это взаимодействия – межмолекулярные силы и пр.
3. Процесс адсорбции – обратимый процесс. Связывание вещества сопровождается одновременным его высвобождением, т.е. наряду с адсорбцией идет десорбция. Процесс завершается установлением адсорбционно-десорбционного равновесия.
4. Каждый адсорбционный центр может удержать только одну молекулу сорбата, в результате чего образуется мономолекулярный слой адсорбированных молекул. Т.е. поверхность сорбента может быть покрыта максимум одним слоем молекул сорбата.
Современная теория сорбции допускает образование полимолекулярных слоев (Поляни), исходя из предположения что один центр может связать не одну, а несколько молекул – как например, при сорбции азота на оксидах металлов при низких температурах.
Сорбция веществ на поверхности твердого тела при постоянной температуре: из изотермы адсорбции видно, что при увеличении концентрации растворенного вещества (или давления газа) величина сорбции растет, но наступает момент, когда все активные центры уже заняты молекулами сорбата и увеличения сорбции уже не происходит, а изотерма адсорции вышла на плато (рисунок- изотерма адсорбции, см.ниже).
Повышение температуры и понижение давления приводят к десорбции газов и паров. Вследствие этого сорбционно-десорбцнонные методы широко применяют в промышленности для извлечения различных веществ из воздушной среды, а также для разделения газов и паров.

Уравнение Ленгмюра применяется для расчета количества сорбированного вещества из раствора:

Оно описывает адсорбцию при образовании мономолекулярного слоя. Адсорбция газов описывается тем же выражением.
Сорбция из растворов
При адсорбции растворенных веществ из растворов на твердых адсорбентах всегда, в той или иной степени, происходит также адсорбция растворителей. Поэтому адсорбция из растворов носит конкурентный характер между поглощением растворенных веществ и растворителя. Адсорбироваться могут как растворенные неэлектролиты, так и электролиты. В связи с этим различают адсорбцию из растворов:
· молекулярную
· ионную
Молекулярная адсорбция – сорбция неэлектролитов или слабых электролитов на твердой поверхности. На сорбцию недиссоциирующих или слабо диссоциирущих молекул большое влияние оказывает:
· природа поверхности,
· природа растворителя.
Сцелью уменьшения адсорбции растворителя при молекулярной сорбции из водных растворов обычно применяют гидрофобный (т.е. не смачиваемый водой) адсорбент — активный уголь, а при сорбции из неполярных растворителей (углеводородов) гидрофильный (т.е. смачиваемый водой) адсорбент — силикагель. Из водных растворов гидрофобные (неполярные вещества), ПАВы хорошо адсорбируются на гидрофобной поверхности. На гидрофильной поверхности будут в большей степени адсорбироваться молекулы воды, чем молекулы растворенного вещества. Из неводных неполярных растворителей, таких как хлороформ, углеводороды, те же вещества будут лучше сорбироваться на гидрофильной поверхности, чем на гидрофобной.
Адсорбция протекает по активным центрам адсорбента, часто мономолекулярно и высокоизбирательно. Изотермы молекулярной адсорбции из растворов, так же как газов и паров, имеют вид кривой. Десорбцию, осуществляемую с помощью жидкостей, обычно называют элюцией, а жидкости или растворы, применяемые для этих целей, элюентами.
Ионная адсорбция. Сильные электролиты в отличие от недиссоциирующих и слабодиссоциирующих соединений адсорбируюся из растворов в виде ионов, а не молекул. При этом основную роль играют электростатические связи. Различают 2 механизма адсорбции ионов на поверхности твердого тела:
· ионный обмен,
· избирательная сорбция.
Ионообменная адсорбция
При адсорбции электролитов преимущественно адсорбируются или катионы, или анионы, которые заменяются на эквивалентное количество ионов того же знака из адсорбента. Раствор остается при этом электронейтральным. Таким образом, адсорбция электролитов происходит путем эквивалентного обмена ионов одинакового знака, а потому получила название ионообменной адсорбции. Ионообменный механизм адсорбции электролитов первоначально был подмечен агрономами и почвоведами при вытеснении одних ионов почвенных электролитов другими. К. К. Гедройц доказал (1918 г.) эквивалентность обмена катионов в почвах и создал учение о почвенном поглощающем комплексе (высокодисперсной органоминеральной части почвы), обусловливающем способность почв удерживать необходимые растениям растворимые соли в доступной для корневого питания форме.
Неорганические и органические материалы, способные к обмену ионов, получили название ионитов. Они могут иметь кислотный, основной или амфотерный характер. Иониты делят на:
· катиониты (для обмена катионов),
Сорбенты кислотного типа содержат остатки различных кислот серной, фосфорной, органических кислот, пришитых к полимеру. Они способны обменивать ион водорода на катионы металлов.
R-SO3H + Na+ <=> R-SO3Na + H+
· и аниониты (для обмена анионов).
Сорбенты основного типа содержат группы OH и способны обменивать их на анион.
Сорбенты амфотерного типа обмениваются как катионы, так и анионы.
Разнообразные синтетические ионообменные материалы химической промышленностью выпускаются в виде зернистых порошков, волокон и мембран. Природные это цеолиты и глаукониты. Применяются для очистки воды, удаления тяжелых металлов из сточных вод.
Органические и неорганические иониты нерастворимы в воде. Они представляют собой трехмерный каркас, в который включены несущие заряд группы атомов, называемые потенциалопределяющими ионами. Ионы противоположного знака называют противоионами. Они связаны с потенциалопределяющими нонами каркаса электростатическими силами, а потому способны к обмену на другие ионы. Так, структуру стекла составляет трехмерная сетка кремнекислородных (силикатных) ионов. В пустотах этой трехмерной кремнекислородной решетки находятся катионы щелочных или щелочноземельных металлов, удерживаемые электростатическими силами и способные к обмену на другие катионы (в частности, на ионы водорода).
В органических ионитах трехмерный каркас образован сеткой из углеродных атомов, с которыми ковалентно связаны, например, сульфо-, карбокси- или триметиламмоний-группы:

Схема ионного обмена катионов на Н+-форме катионита и обмен анионов на ОН--форме анионита:

Потенциалопределяющие - ионогенные группы, химически связанные с каркасом ионита: соответственно (-) и (+). Катионит в Н+ -форме, анионит в ОН--форме; Н+ и ОН- — ноны, которые в растворе NaCl обмениваются, соответственно, на ионы Nа+ и Cl-.
Ионный обмен является обратимым процессом. Катионит как поливалентный электролит с валентностью х запишем схематично как Rx-.Тогда после внесения Н+-формы катионита в раствор электролита, например, NaCl, установится равновесие:

Максимальное количество ионов, которое поглощается обменным путем 1 г. ионита, называют емкостью поглощения, или обменной емкостью. Она достигает 6—10 мэкв/г. Ионообменное равновесие определяется:
· природой ионита,
· гидратацией обменивающихся ионов,
· концентрацией в фазе ионита и в растворе.
Обмен разновалентных ионов зависит также от величины их заряда. Большой вклад в разработку теории и практики ионного обмена внес Б. П. Никольский.
Иониты широко используют для уменьшения жесткости воды и ее обессоливания, для выделения и разделения разнообразных неорганических и органических ионов. Ионный обмен используют в кожевенной, гидролизной, фармацевтической промышленности для очистки растворов, а также для удаления солей из сахарных сиропов, молока, вин. С помощью ионитов улавливают ионы цепных элементов из природных растворов и отработанных вод различных производств. Промышленное производство многих продуктов жизнедеятельности микроорганизмов (антибиотиков, аминокислот) оказалось возможным или было значительно удешевлено благодаря использованию ионитов. Применение ионного обмена позволило усовершенствовать методы качественного и количественного анализа многих неорганических и органических веществ.
К веществам, обладающим ионообменными свойствами, принадлежат некоторые марки стекол. Их структуру составляет силикатный каркас и электростатически связанные с ним катионы, способные к обмену на ионы водорода раствора. Из таких стекол изготовляют стеклянные электроды, обладающие свойствами водородного электрода. Стеклянные электроды применяют для определения pH растворов в условиях, когда пользование водородным электродом затруднительно или невозможно (например, в присутствии сильных окислителей). Разработаны также стекла, электродный потенциал которых определяется концентрацией ионов металлов, — например, иона натрия.
Хроматография.
Мысль о том, что адсорбция в динамических условиях улучшит разделение сложных смесей, впервые возникла у М. С. Цвета. Исходя из этой идеи, он в 1903 г. предложил новый метод анализа таких смесей, названный им хроматографическим.
Все хроматографические системы системы состоят из двух фаз - неподвижной и, которая может быть жидкой или твердой, и подвижной, которая обычно пропускается через неподвижную фазу и может быть жидкой или газообразной. Разделение веществ основано на их различном распределении подвижной и неподвижной фазах, а соотношение концентраций веществ в этих фазах называется коэффициентом распределения.
Сущность метода заключается в следующем:
Раствор исследуемой смеси вводят в «хроматографическую колонку» — стеклянную трубку, заполненную адсорбентом, предварительно промытым, а затем пропитанным растворителем. Компоненты смеси адсорбируются в верхней части колонки, не разделяясь или разделяясь лишь частично; образуется первичная хроматограмма (а):

Затем ее «проявляют». Для этого в колонку подают чистый растворитель (элюент), который десорбирует ранее адсорбированные вещества и перемещает их со своим потоком вниз по колонке. При движении по колонке происходят многократные акты адсорбции и десорбции, приводящие к разделению компонентов смеси в соответствии с законом адсорбционного замещения М. С. Цвета (1910 г.), который состоит в следующем: если растворенные вещества А, В, С,... по своему относительному сродству к адсорбенту образуют адсорбционный ряд А > В > С..., тогда каждый из членов адсорбционного ряда вытесняет последующий и, в свою очередь, вытесняется предыдущими, более сильно адсорбирующимися. В результате на колонке образуется проявленная хроматограмма (б):

М. С. Цвет применил этот метод для разделения на адсорбентах белого цвета (мел, оксид кальция, крахмал, целлюлоза) смеси пигментов листьев растений. Проявленная хроматограмма расцвечивалась зонами разнообразной окраски. Отсюда возникло название предложенного М. С. Цветом метода — хроматография («цветозапись» от греч. «хромое» — цвет, «графе» — писать).
Продолжая промывание колонки растворителем, достигают выхода из нее разделяющихся веществ, которые обнаруживают путем анализа последовательных порций вытекающего из колонки раствора (элюата). Если построить выходную кривую, т. е. график зависимости концентрации элюата (С) от объема пропущенного через колонку раствора (V), то па этой кривой выходу компонентов исходной смеси из колонки соответствуют хроматографические пики.
Часто не происходит полного разделения компонентов и отдельные пики взаимно перекрываются. Построение выходных кривых является наиболее распространенной формой колоночной хроматографии, так как не связано ни с окраской разделяемых компонентов, ни с цветом адсорбента.

В 1936 г. М. М. Дубинин осуществил адсорбционную хроматографию паров; в последующие годы появились новые варианты хроматографического метода. В настоящее время хроматографией называют такие физико-химические методы разделения компонентов смесей газов, паров, жидкостей или растворенных веществ, которые осуществляют путем сорбции в динамических условиях.
В зависимости от преобладающего физико-химического сорбционного процесса, определяющего разделение компонентов смеси, различают хроматографию:
· адсорбционную, (Разделение основано на различном сродстве веществ к сорбенту)
· ионообменную (Основана на неодинаковой способности ионов к обмену с сорбентом)
· распределительную (Разделение основано на различной растворимости веществ в подвижной и неподвижной фазах)
· проникающую (на различиях в размерах молекул или в величине зарядов молекул или частиц (молекулярные сита))
· эксклюзионную (Разделение происходит за счет распределения молекул между его частицами)
· афинную (к сорбенту пришивается лиганд (маленькая молекула), с которой специфично связывается макромолекула)
Зерна адсорбента или ионита могут заполнять колонну (колоночная хроматография) или составлять тонкий плотный слой на стеклянной пластинке (тонкослойная хроматография).
Создание и совершенствование хроматографических методов исследования в значительной степени обусловило быстрые темпы развития современной молекулярной биологии, химии редкоземельных и трансурановых элементов. Хроматографические методы выделения и разделения разнообразных веществ осуществлены также в крупных промышленных масштабах.
Большое значение для анализа очень малых объемов растворов (0,01—ОД мл) приобрела распределительная хроматография на бумаге, предложенная Консденом (Англия) в 1944г. Она основана на том, что между двумя несмешивающимися жидкостями третий компонент распределяется в соответствии с характерным для этого вещества коэффициентом распределения, представляющим отношение его концентраций в граничащих жидкостях.
Для осуществления хроматографического процесса необходимо, чтобы один слой жидкости перемещался относительно другого. В этом случае распределение растворенных веществ между двумя слоями жидкости происходит многократно в динамических условиях. При хроматографии на бумаге одна, более полярная жидкость сорбируется волокнами бумаги, образуя фиксированную (неподвижную) жидкую фазу; другая, менее полярная жидкость, смачивая волокна бумаги, поднимается по листу в силу явления капиллярного поднятия.
Вопрос 16
σ- и π- связи, их характеристика (на примерах геометрии молекул N2, CO2, NH3, СH4, H2O, BF3, BeCe2, С2H4, С2H2). Одинарная, двойная и тройная связь: энергия, длина и валентные углы.
Направленность ковалентной связи
Поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают:
· σ-,
· π-,
· δ- связи
Схемы перекрывания орбиталей при образовании σ-, π-, δ- связей:

σ-связи π-связи δ- связи
Сигма-связь ( σ)осуществляется при перекрывании облаков вдоль линии соединения атомов.
Пи-связь ( π) возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов.
Дельта-связь ( δ) обязана перекрыванию всех четырех лопастей (d-электронных облаков, расположенных в параллельных плоскостях.
Исходя из условий симметрии, можно сказать, что электроны s-орбиталей могут участвовать лишь в σ -связывании, р-электроны — уже в σ - и π -связывании, а d-электроны — как в σ - и π-, так и вδ-связывании. Для f-орбиталей способы перекрывания еще разнообразнее.
Максимальное перекрывание облаков, образующих σ-связи, совпадает с линией, соединяющей центры атомов. Поскольку электронные облака (кроме s-облака) направлены в пространстве, то и химические связи, образуемые с их участием, пространственно направлены. Так, гантелевидные р-орбитали расположены в атоме взаимно перпендикулярно. Следовательно, угол между связями, образуемыми электронами атома, должен быть 90°. Таким образом, пространственное расположение σ-связей определяет пространственную конфигурацию молекул.
Пространственные формулы молекул весьма разнообразны. Так, молекула СО2 имеет линейную структуру, молекула СН4 — тетраэдрическую, молекула NH3 — пирамидальную, H2O — угловую, SO3 — треугольную.
Для объяснения пространственной конфигурации молекул существует ряд теорий (моделей).
Модель гибридизации атомных орбиталей
Обычно химические связи образуются за счет электронов разных энергетических состояний атома. Так, у атомов бериллия (2s22p1), бора (2s12p2) и углерода (2s12p3) в образовании связей одновременно принимают участие как s- так и р-электроны. Несмотря на различие форм исходных электронных облаков связи, образованные с их участием, оказываются равноценными и расположенными симметрично. В молекулах ВеСl2, ВСl3 и ССl4, например, валентный угол С1ЭСl равен 180°, 120° и 109°28' соответственно:

Гибридизация валентных орбиталей дает представление о том как неравноценные по исходному состоянию электроны образуют равноценные химические связи.
Согласно этому представлению химические связи формируются электронами не "чистых", а "смешанных", так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии.
Следует отметить, что, как физический процесс, гибридизация орбиталей не существует. Теория гибридизации представляет собой удобную модель наглядного описания молекул.
Когда говорят о формах молекул, прежде всего имеют в виду взаимное расположение в пространстве ядер атомов. О форме молекулы имеет смысл говорить, когда молекула состоит из трех и более атомов (два ядра всегда находятся на одной прямой). Форма молекул определяется на основе теории отталкивания валентных (внешних) электронных пар. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии). При этом необходимо иметь в виду следующие утверждения теории отталкивания.
1. Наибольшее отталкивание претерпевают неподеленные электронные пары.
2. Несколько меньше отталкивание между неподеленной парой и парой, участвующей в образовании связи.
3. Наименьшее отталкивание между электронными парами, участвующими в образовании связи. Но и этого бывает недостаточно, чтобы развести ядра атомов, участвующих в образовании химических связей, на максимальный угол.
На рисунке форма sp-гибридной орбитали, возникшая за счет комбинации s- и р- орбиталей. Она больше вытянута по одну сторону от ядра, чем по другую, т.е. электронная плотность в ней сконцентрирована по одну сторону в большей степени, чем по другую. Поэтому химическая связь, образованная с участием электрона гибридной орбитали, должна быть более прочной, чем образованная электронами отдельных s- и р- орбиталей.

Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию молекул. Так, при комбинации одной s- и одной р- орбитали возникают две sр-гибридные орбитали, расположенные симметрично под углом 180°:

Отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180°. Например, у атома бериллия sр- гибридизация орбиталей проявляется в молекуле ВеС12 (аналогично у CO2), которая вследствие этого имеет линейную форму.
